题目内容
13.下列说法不正确的是( )| A. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| B. | 将一块未擦去氧化膜的铝片分别投入1 mol•L-1 CuSO4溶液中,铝片表面观察不到明显的反应现象 | |
| C. | 制取摩尔盐时和制取阿司匹林时都可用酒精洗涤产品 | |
| D. | 在AlCl3溶液中先滴加足量的NH4F溶液,在滴加氨水,将看不到溶液变浑浊 |
分析 A.铁锌在酸性环境下形成原电池,能够加速氧化还原反应速率;
B.氧化膜性质稳定;
C.摩尔盐在有机溶剂中的溶解度小,阿司匹林为有机物,易溶于有机溶剂;
D.氟化铵溶液中氟离子和铵根离子双水解,氟离子水解程度小于铵根离子,溶液显酸性.
解答 解:A.铁锌在酸性环境下形成原电池,能够加速氧化还原反应速率,镀锌铁皮中锌镀层如果被反应掉,则反应产生氢气的速率会显著减慢,故A正确;
B.将一块未擦去氧化膜的铝片分别投入1 mol•L-1 CuSO4溶液中,因为氧化膜性质稳定,所以不会与硫酸铜溶液发生反应,没有明显的现象,故B正确;
C.制取摩尔盐时可用酒精洗涤产品,制取阿司匹林应用冷水洗涤,故C错误;
D.氟化铵溶液中氟离子和铵根离子双水解,氟离子水解程度小于铵根离子,溶液显酸性,所以滴加氨水将看不到溶液变浑浊,故D正确;
故选:C.
点评 本题考查了原电池的应用,盐类水解规律,物质的溶解性,题目综合性较强,难度较大,选项AD为易错选项.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
3.铁有δ、γ、α三种同素异形体,如下图所示,三种晶体在不同温度下能发生转化.下列说法不正确的是( )
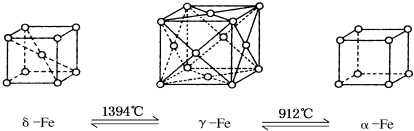

| A. | 将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同 | |
| B. | α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个 | |
| C. | 若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3:a3 | |
| D. | δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个 |
1.下列说法正确的是( )
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入水玻璃(Na2SiO3溶液)可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2SiO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 因为NH3•H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3 |
8.对于可逆反应:2SO2+O2?2SO3,在某密闭容器中达到化学平衡状态后,再往此容器中通入18O2,较长时间后,下列有关说法中正确的是( )
| A. | 18O原子只存在氧气中 | |
| B. | 18O原子只存在三氧化硫中 | |
| C. | 18O一定不存在二氧化硫中 | |
| D. | 氧气中,二氧化硫中,三氧化硫中都可能存在18O |
18.下列能级符号表示错误的是( )
| A. | 2p | B. | 4d | C. | 5s | D. | 3f |
5.在下列反应中,既属于氧化还原反应,同时又属于吸热反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | H2与Cl2的燃烧反应 | ||
| C. | 铝与稀盐酸反应 | D. | 灼热的碳与CO2反应 |
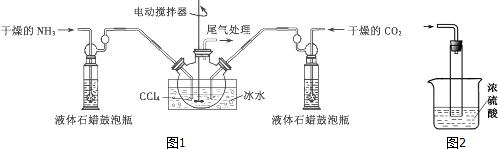
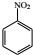 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$
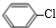 +HNO3$→_{△}^{浓H_{2}SO_{4}}$
+HNO3$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.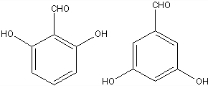 、
、 .
.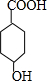 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$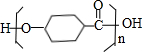 +(n-1)H2O.
+(n-1)H2O.