题目内容
17.实验是研究化学的基础,如图中所示的实验方法、装置或操作完全正确的是( )| A. |  点燃酒精灯 | B. |  液体加热 | C. |  称量固体 | D. |  量9.5mL液体 |
分析 A.点燃酒精灯要用火柴;
B.试管内的液体不可超过试管容积的三分之一,用外焰加热;
C.天平称量时指针位于中间;
D.根据控制误差到最小判断.
解答 解:A.点燃酒精灯要用火柴,不可用燃着的酒精灯,故A错误;
B.给试管内液体加热时,试管内的液体不可超过试管容积的三分之一,用外焰加热,试管夹在据试管口三分之一处,故B正确;
C.天平称量时指针位于中间,不能偏向一边,故C错误;
D.为减少误差,量取9.5mL液体,应该用10mL的量筒,而不是100mL的量筒,故D错误.
故选B.
点评 本题考查化学实验的基本操作,题目难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
7.下列叙述不正确的是( )
| A. | 溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 与足量稀盐酸反应:Na2CO3比NaHCO3更剧烈 | |
| D. | 等质量的Na2CO3和NaHCO3分别与足量稀盐酸反应:Na2CO3放出的CO2更多 |
5.有关氧元素及含氧物质表示正确的是 ( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氧离子(O2-)的结构示意图: | |
| C. | 某氧单质的球棍模型: | |
| D. | 某碳氧化合物电子式: |
2.下列反应的离子方程式书写正确的是( )
| A. | 用小苏打治疗胃酸过多:CO3-+2H+═CO2↑+H2O | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 硫酸铜溶液中加入过量铁粉:Cu2++2Fe═2Fe3++Cu | |
| D. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O |
7.分子式为C5H10O2的有机物,且只含一个官能团的所有同分异构体(不考虑立体异构)的数目为( )
| A. | 7种 | B. | 9种 | C. | 11种 | D. | 13种 |
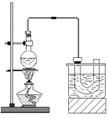 实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:
实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题: