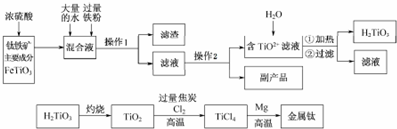
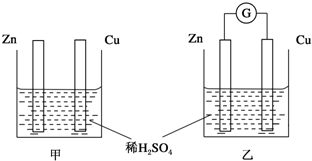
题目内容
2.化学反应方程式或离子方程式是学习化学的基本工具,请你书写出以下反应的离子方程式:(1)用硫氰化钾检验Fe3+存在的离子方程式:Fe3++3SCN-=Fe(SCN)3
(2)用铁氰化钾检验Fe2+存在的离子方程式:3Fe2++2[Fe(CN)6]=Fe3[Fe(CN)6]2↓
(3)酸性高锰酸钾与草酸溶液反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(4)硫代硫酸钠与稀硫酸反应的方子方程式:2H++S2O32-=S↓+SO2↑+H2O
(5)碳酸钠溶液呈碱性的离子方程式:CO32-+H2O?HCO3-+OH-.
分析 (1)硫氰酸根离子与三价铁离子反应生成硫氰合铁络合物;
(2)铁氰化酸根离子与二价铁离子生成铁氰化亚铁沉淀;
(3)高锰酸钾具有强的氧化性,能够氧化草酸根离子;
(4)硫代硫酸在酸性环境下发生歧化反应生成硫沉淀和二氧化硫;
(5)碳酸根为多元弱酸根离子,分步水解,以第一步水解为主,水解生成碳酸氢根离子和氢氧根离子;
解答 (1)三价铁离子与硫氰根离子发生络合反应生成硫氰合铁络合物,离子方程式;Fe3++3SCN-=Fe(SCN)3;
故答案为:Fe3++3SCN-=Fe(SCN)3;
(2)铁氰化酸根离子与二价铁离子生成铁氰化亚铁沉淀,离子方程式:3Fe2++2[Fe(CN)6]═Fe3[Fe(CN)6]2↓;
故答案为:3Fe2++2[Fe(CN)6]═Fe3[Fe(CN)6]2↓;
(3)高锰酸钾氧化草酸生成二氧化碳和水,本身被还原为二价锰离子,离子方程式:5H2C2O4+6H++2MnO4-═10CO2↑+2Mn2++8H2O;
故答案为:5H2C2O4+6H++2MnO4-═10CO2↑+2Mn2++8H2O;
(4)硫代硫酸在酸性环境下发生歧化反应生成硫沉淀和二氧化硫,离子方程式:2H++S2O32-=S↓+SO2↑+H2O;
故答案为:2H++S2O32-=S↓+SO2↑+H2O;
(5)碳酸根分步水解,以第一步水解为主,水解生成碳酸氢根离子和氢氧根离子,离子方程式:CO32-+H2O?HCO3-+OH-;
故答案为:CO32-+H2O?HCO3-+OH-;
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意多元弱酸分步水解,题目难度中等.

练习册系列答案
相关题目
1.玻璃仪器里,如附有不溶性的碳酸盐,正确的洗涤方法是( )
| A. | 用稀盐酸冲洗 | B. | 加稀盐酸溶解,再用蒸馏水冲洗 | ||
| C. | 用热的碳酸钠溶液冲洗 | D. | 加热,使碳酸盐分解 |
2.反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g) 在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加Fe(s)的量 | B. | 将容器的体积缩小一半 | ||
| C. | 升高温度 | D. | 通入水蒸气 |
19.某有机物的结构简式为 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 共平面的原子最多有19个 | B. | 共平面的原子至少有10个 | ||
| C. | 共平面的碳原子最多有11个 | D. | 共直线的碳原子最多有4个 |
6.相同状况下,等质量的下列烃类燃烧产生的CO2比乙烯低的是( )
| A. | C2H6 | B. | C2H2 | C. | C3H6 | D. | C6H6 |
11.据科学家预测,月球的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,每百吨${\;}_{2}^{3}$He核聚变所释放的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以${\;}_{2}^{4}$He的形式存在.下列说法正确的是( )
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| C. | ${\;}_{2}^{3}$He原子核内含有3个中子 | |
| D. | ${\;}_{2}^{4}$He最外层电子数为2,具有较强金属性 |
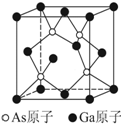 氮族元素和硼族元素在生产生活中有很重要的地位.
氮族元素和硼族元素在生产生活中有很重要的地位.