题目内容
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、5.6g Fe与足量稀盐酸反应转移的电子数为0.3NA |
| B、常温常压下,23g NO2含有NA个氧原子 |
| C、标准状况下,22.4L水含有个NA H2O分子 |
| D、1mol/L NaCl溶液含有NA个Na+ |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.铁与稀盐酸反应生成的是亚铁离子,5.6g铁的物质的量为0.1mol,与足量盐酸反应失去0.2mol电子;
B.二氧化氮和四氧化二氮在最简式为NO2,根据最简式计算出含有的氧原子数目;
C.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量;
D.缺少氯化钠溶液的体积,无法计算溶液中钠离子数目.
B.二氧化氮和四氧化二氮在最简式为NO2,根据最简式计算出含有的氧原子数目;
C.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量;
D.缺少氯化钠溶液的体积,无法计算溶液中钠离子数目.
解答:
解:A.5.6g铁的物质的量为0.1mol,0.1mol铁与足量稀盐酸反应生成0.1mol氢气,失去了0.2mol电子,转移的电子数为0.2NA,故A错误;
B.23g二氧化氮的物质的量为0.5mol,含有1mol氧原子,含有NA个氧原子,故B正确;
C.标准状况下,水不是气体,不能使用标况下的气体摩尔体积计算22.4L水的物质的量,故C错误;
D.没有告诉氯化钠溶液的体积,无法计算溶液中钠离子的物质的量及数目,故D错误;
故选B.
B.23g二氧化氮的物质的量为0.5mol,含有1mol氧原子,含有NA个氧原子,故B正确;
C.标准状况下,水不是气体,不能使用标况下的气体摩尔体积计算22.4L水的物质的量,故C错误;
D.没有告诉氯化钠溶液的体积,无法计算溶液中钠离子的物质的量及数目,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下水的状态不是气体,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,注意缺少溶液体积.

练习册系列答案
相关题目
下列物质分别与CuSO4、NaCl、Fe2(SO4)3、MgSO4等溶液混合时,产生的现象各不相同的是( )
| A、盐酸 | B、氢氧化钾溶液 |
| C、氯化钡溶液 | D、硫酸钠溶液 |
下列说法正确的是( )
| A、已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,则H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=2×(-57.3)kJ?mol-1 | ||||
| B、已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | ||||
C、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
| ||||
D、葡萄糖的燃烧热是2 800 kJ?mol-1,则
|
下列实验操作正确的是( )
| A、在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 |
| B、实验室制乙烯时,迅速升温到140℃ |
| C、用乙醇和浓硫酸除去乙酸乙酯中混有的少量乙酸 |
| D、用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 |
常温下,分别将4块形状相同,质量均为7g的铁片同时放入下列4种溶液中,产生气体速率最大的是( )
| A、150mL 2mol?L-1盐酸 |
| B、150mL 2mol?L-1硫酸 |
| C、500mL 3mol?L-1盐酸 |
| D、500mL 18.4mol?L-1硫酸 |
下列关于氯水的说法中,不正确的是( )
| A、新制氯水具有漂白作用 |
| B、新制氯水呈黄绿色 |
| C、新制氯水应避光保存 |
| D、氯水是指液态的氯 |
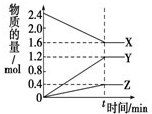 (1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为
(1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为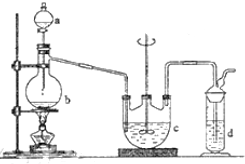 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.回答下列问题: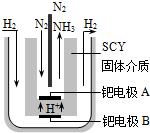 合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.
合成氨对工农业发展有着重要意义,下面是对有关其应用的研究.