题目内容
16.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)?xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol•L-1•min-1,下列说法正确的是( )| A. | 以B表示的平均反应速率为v(B)=0.0625mol•L-1•s-1 | |
| B. | 4min时,A的物质的量为0.75mol | |
| C. | 该反应方程式中,x=2 | |
| D. | 4min时,B的转化率为25% |
分析 设A、B的物质的量分别为nmol,4min后C的浓度为0.125mol•L-1•min-1×4min=0.5mol/L,则4min后c(C)=0.5mol/L×2L=1mol,n(D)=0.5mol/L×2L=1mol,
3A(g)+B(g)?xC(g)+2D(g)
起始:nmol nmol 0 0
转化:1.5mol 0.5mol 0.5x 1mol
平衡:(n-1.5)mol (n-0.5)mol 1mol 1mol
则(n-1.5):( n-0.5)=3:5,n=3,x=2,以此解答该题.
解答 解:设A、B的物质的量分别为nmol,4min后C的浓度为0.125mol•L-1•min-1×4min=0.5mol/L,则4min后c(C)=0.5mol/L×2L=1mol,n(D)=0.5mol/L×2L=1mol,
3A(g)+B(g)?xC(g)+2D(g)
起始:nmol nmol 0 0
转化:1.5mol 0.5mol 0.5x 1mol
平衡:(n-1.5)mol (n-0.5)mol 1mol 1mol
则(n-1.5):(n-0.5)=3:5,n=3,x=2,
A.以B表示的平均反应速率为v(B)=$\frac{1}{2}$×v(C)=$\frac{1}{2}$×0.125mol•L-1•min-1=0.065mol•L-1•min-1,故A错误;
B.4min时,A的物质的量为3mol-1.5mol=1.5mol,故B错误;
C.化学反应中物质的量变化量之比等于化学计量数之比,则x=2,故C正确;
D.4min时,A的转化率为$\frac{1.5mol}{3mol}$=50%,故D错误.
故选C.
点评 本题考查了化学反应速率与化学计量数的关系,题目难度中等,根据反应物的物质的量关系运用三段式法计算平衡时的物质的量是解答该题的关键,注意同一反应中反应速率之比等于化学计量数之比.

 53天天练系列答案
53天天练系列答案①NH3的熔、沸点比VA族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定.
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
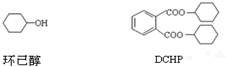
| A. | DCHP的分子式为C20H26O4 | |
| B. | 环己醇分子中所有碳原子不可能共平面 | |
| C. | DCHP的一氯取代物有5种 | |
| D. | DCHP通过取代反应可以得到环已醇 |
 海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca2++2HCO3-?CaCO3+H2O+CO2.与珊瑚虫共生的藻类会消耗海洋中的CO2.气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡.下列说法不合理的是( )
海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca2++2HCO3-?CaCO3+H2O+CO2.与珊瑚虫共生的藻类会消耗海洋中的CO2.气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡.下列说法不合理的是( )| A. | 共生藻类消耗CO2,有利于珊瑚的形成 | |
| B. | 海洋中CO2浓度升高,抑制了珊瑚的形成 | |
| C. | 温度升高会增大CO2在海水中的溶解度,抑制了珊瑚的形成 | |
| D. | 将CO2转化为甲醇等化工原料,有助于缓解温室效应 |
| A. | 漂白粉中加入浓盐酸:ClO-+Cl-+2H+═Cl2↑+H2O | |
| B. | 氯化铁溶液洗涤银镜:Fe3++Ag═Fe2++Ag+ | |
| C. | 0.1 mol•L-1NH4HSO4溶液和0.1 mol•L-1NaOH等体积混合:NH4++H++2OH-═NH3•H2O+H2O | |
| D. | 0.1 mol•L-1的NaAlO2溶液和0.15 mol•L-1的H2SO4溶液等体积混合:AlO2-+4H+═Al3++2H2O |
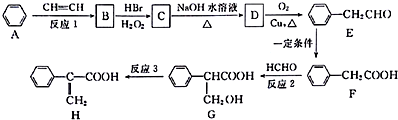
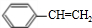 .
.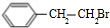 ;②D-E的化学方程式是2
;②D-E的化学方程式是2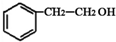 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2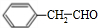 +2H2O;
+2H2O;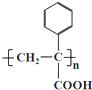
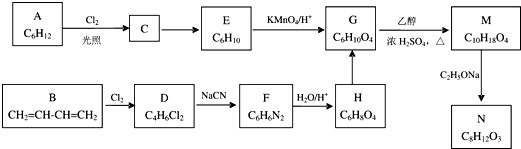
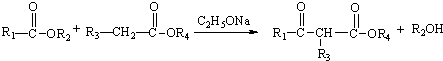
 .
. .
. .
.