题目内容
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.常温下,由水电离的c(H+)=10-13 mol·L-1的溶液中:Na+、NH4+、Cl-、HCO3-
B.酸性碘化钾溶液中滴加适量双氧水:2I— 2H+ H2O2=I2 2H2O
C.氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42—=BaSO4
D.向饱和碳酸钠溶液中通入二氧化碳:CO32— CO2 H2O=2HCO3—
【答案】B
【解析】
A、由水电离的c(H+)=10-13 mol·L-1的溶液可能呈酸性,也可能呈碱性,NH4+与OH-能够发生反应,HCO3-与H+和OH-均能反应,因此不能大量共存,故A错误;
B、I-具有还原性,H2O2具有氧化性,在酸性条件下,二者能够发生氧化还原反应:2I-2H+H2O2=I2 2H2O,故B正确;
C、氢氧化钡溶液与硫酸铜溶液反应离子方程式为:![]() ,故C错误;
,故C错误;
D、因碳酸钠溶解度大于碳酸氢钠,向饱和碳酸钠溶液中通入二氧化碳充分反应后生成的碳酸氢钠会析出,因此其离子反应方程式为:![]() ,故D不正确;
,故D不正确;
故答案为:B。

【题目】由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g)△H1=-36kJ·mol-1
2CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,年生产lmolCO,转移电子的数目为______________________。
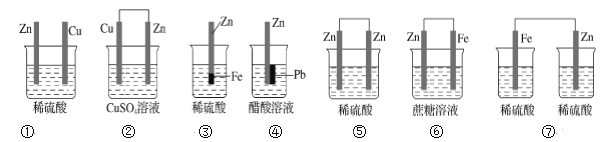
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
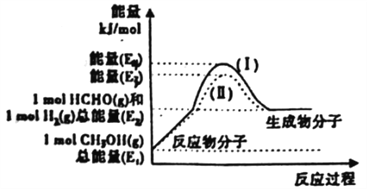
①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程II(填“大于”、“小于”或“等于”)。
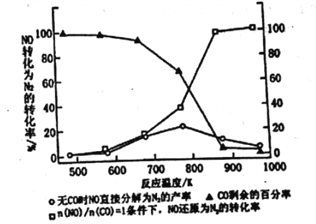
II.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,删得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,
在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。