题目内容
【题目】将4mol A 气体和2mol B 气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g) B(g) 2C(g) 。若经 2s 后测得C 的浓度为 0.6mol·L-1,现有下列几种说法:
①用物质A 表示的反应平均速率为 0.3mol·L-1·s-1
②用物质B 表示的反应的平均速率为 0.6mol·L-1·s-1
③2s 时物质A 的转化率为 70%
④2s 时物质B 的浓度为 0.7mol·L-1
其中正确的是( )
A.①③B.①④C.②③D.③④
【答案】B
【解析】
由已知2s后C的浓度为0.6mol/L,根据c=![]() 可知C的物质的量为1.2mol。则:
可知C的物质的量为1.2mol。则:
2A(g)B(g)2C(g)
开始(mol) 4 2 0
转化(mol) 1.2 0.6 1.2
2s时(mol) 2.8 1.4 1.2
v(C)= =0.3mol·L-1·s-1,
=0.3mol·L-1·s-1,
①速率之比等于化学计量数之比,v(A)=v(C)=0.3mol·L-1·s-1,故①正确;
②速率之比等于化学计量数之比,v(B)=![]() v(C)=0.15mol·L-1·s-1,故②错误;
v(C)=0.15mol·L-1·s-1,故②错误;
③2s时物质A的转化率=![]() 30%,故③错误;
30%,故③错误;
④2s 时物质B的浓度c(B)=![]() 0.7mol·L-1,故④正确;
0.7mol·L-1,故④正确;
故答案:B。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】氢气和二氧化碳在一定条件下可合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
I、在恒温条件下,分别将2 molCO2和6 mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(CH3OH)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(CH3OH)/mol | 0 | 0.50 | 0.80 | 0.90 | 0.99 | 1.00 | 1.00 |
(1)前10min中利用CO2表示的反应速率为____________。
(2)该温度下,此反应的平衡常数K=__________。
(3)该温度下,若向同容积的另一容器中投入的:CO2、H2、CH3OH、H2O的浓度分别为2 mol·L-1、2 mol·L-1、1 mol·L-1、1 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
Ⅱ、在密闭容器中充入1molCO2和3 mol H2,测得混合气体中甲醇的体积分数与温度的关系如图A所示:
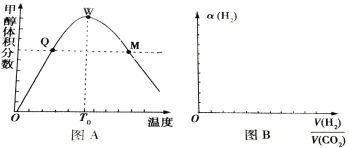
试回答下列问题:
(1)该反应是______(填“放热”或“吸热”)反应。
(2)氢气在Q点的转化率_________(填“大于”、“小于”或“等于”,下同)氢气在W点的转化率;
(3)解释0—T0内,甲醇的体积分数变化趋势:_______________。
(4)图B表示氢气转化率α(H2)与投料比![]() 的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。