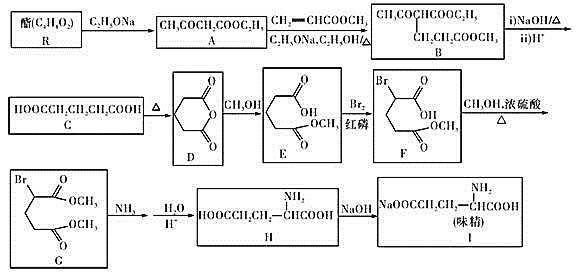
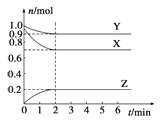
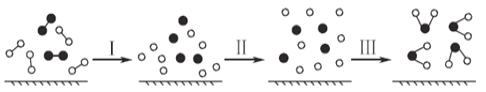
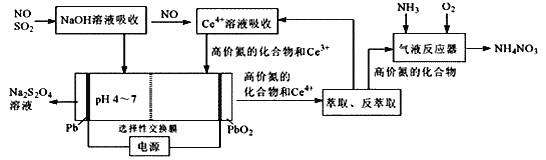
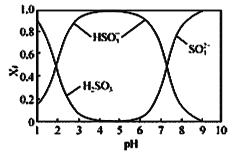
题目内容
【题目】基础知识与技能考查
(1)Na2S2O3与稀硫酸反应(化学方程式):___;
(2)泡沫灭火器是硫酸铝和碳酸氢钠溶液反应,写出相关离子方程式:___;
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是___。(填写化学式,只填一种即可)
(4)碳酸氢钠溶液中:比较c(H2CO3)___c(CO32-)(答>,<,=)
(5)常温下,将0.1mol/L盐酸和0.1mol/L的NaOH按体积比11:9混合后,溶液的pH为___;
(6)写出碳酸钠溶液的物料守恒___;在2mol/L的氨水中,加入等体积1mol/L的盐酸,写出质子守恒(水的电离守恒):___;
(7)如图是甲烷燃料电池原理示意图,回答下列问题:电池的负极是___(填“a”或“b”)极,该极的电极反应式是___。

【答案】Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O Al3++3HCO3-=Al(OH)3↓+3CO2↑ MgO或Mg(OH)2或MgCO3 > 12 c(Na+)=2c(CO32-)+2c(HCO3-)+2(H2CO3) c(NH4+)+2c(H+)= 2c(OH-)+c(NH3·H2O) a CH4+10OH8e=CO32+7H2O
【解析】
(1)Na2S2O3与稀硫酸会发生歧化反应;
(2)硫酸铝和碳酸氢钠会发生双水解反应;
(3)Fe3+易水解生成沉淀,可通过调节溶液pH的方法促进Fe3+的水解,注意不能引入新的杂质;
(4)碳酸氢钠溶液中碳酸氢根离子存在水解平衡和电离平衡,其中水解程度大于电离程度;
(5)碱与酸体积分别为11L、9L,等浓度酸与碱混合后,溶液呈碱性,根据c(OH-)=![]() 计算;
计算;
(6)根据盐溶液的三大守恒分析;混合后的溶液为等浓度的一水合氨与氯化铵,根据电荷守恒式与物料守恒式推出其质子守恒式;
(7)碱性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,负极上是燃料发生失电子的氧化反应。
(1)Na2S2O3与稀硫酸发生氧化还原反应,其反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O;
(2)硫酸铝水解显酸性,碳酸氢钠水解显碱性,两者混在一起相互促进水解,生成氢氧化铝沉淀和二氧化碳,发生的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)加入MgO或Mg(OH)2或MgCO3,与氢离子反应,可起到调节溶液pH的作用,促进铁离子的水解生成氢氧化铁沉淀而除去,且不引入新的杂质,故答案为:MgO或Mg(OH)2或MgCO3;
(4)碳酸氢钠溶液中,碳酸氢根离子存在水解平衡为:HCO3-+H2O
![]() H2CO3+OH-,电离平衡为:HCO3-
H2CO3+OH-,电离平衡为:HCO3-![]() H++CO32-,因水解程度大于电离程度,则
H++CO32-,因水解程度大于电离程度,则
溶液中c(H2CO3)>c(CO32-),故答案为:>;
(5)0.1mol/L盐酸和0.1mol/L的NaOH按体积比11:9混合后,溶液显碱性,溶液中的的c(OH-)=![]() =
=![]() =0.01mol/L,则根据Kw= c(OH-)
=0.01mol/L,则根据Kw= c(OH-)![]() c(H+)得到c(H+)=
c(H+)得到c(H+)=![]() =10-12 mol/L,故pH=-lg c(H+)=12,故答案为:12;
=10-12 mol/L,故pH=-lg c(H+)=12,故答案为:12;
(6)碳酸钠溶液存在主要存在的平衡为碳酸根离子的水解平衡,其中钠元素原子与碳元素原子遵循2:1比例关系式,因此其物料守恒式为:c(Na+)=2c(CO32-)+2c(HCO3-)+2(H2CO3);在2mol/L的氨水中,加入等体积1mol/L的盐酸,反应后得到溶液中一水合氨与氯化铵的浓度均为0.05mol/L,根据电荷守恒规律可知:c(NH4+)+c(H+)=c(OH-)+c(Cl-),物料守恒式为2c(Cl-)= c(NH4+)+c(NH3·H2O),联立两式可得质子守恒得:c(NH4+)+2c(H+)= 2c(OH-)+c(NH
(7)碱性甲烷燃料电池中通入甲烷的一极a为原电池的负极,该极上是燃料发生失电子的氧化反应,即CH4+10OH8e=CO32+7H2O,
故答案为:a;CH4+10OH8e=CO32+7H2O;

 阅读快车系列答案
阅读快车系列答案【题目】下列实验中所用的试剂、仪器或用品![]() 夹持装置、活塞、导管省去
夹持装置、活塞、导管省去![]() 能够达到该目的的是
能够达到该目的的是
选项 | 目的 | 试剂 | 仪器或用品 |
A | 验证牺牲阳极的阴极保护法 | 酸化的NaCl溶液、Zn电极、Fe电极、铁氰化钾 | 烧杯、电流表、导线、胶头滴管 |
B | 铝热反应 | 氧化铁、铝粉 | 滤纸、酒精灯、木条、盛沙子的蒸发皿 |
C | 除乙烷中混有的乙烯 | 酸性高锰酸钾溶液 | 气囊、集气瓶、水槽 |
D | 制备乙酸乙酯 | 乙醇、乙酸、饱和碳酸钠溶液 | 大小试管、酒精灯 |
A.AB.BC.CD.D