题目内容
下列说法正确的是:
A.新制氯水中加入固体NaOH, 则:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.25℃时,稀释0.5 mol·L-1的NH4Cl溶液,水解平衡右移,溶液的PH减小
C.常温下,pH=11的碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性
D.测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱
D
【解析】
试题分析:A、新制氯水中加入固体NaOH, 根据电荷守恒知:c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),错误;B、25℃时,稀释0.5 mol·L-1的NH4Cl溶液,水解平衡右移,氢离子的物质的量增大,但溶液体积的增大为主要因素,故氢离子浓度减小,溶液的PH增大,错误;C、常温下,pH=11的碱MOH溶液与pH=3的盐酸等体积混合后,若碱为强碱,二者恰好完全反应生成强酸强碱盐,溶液呈中性;若碱为弱碱,二者反应碱远过量,溶液呈碱性,错误;D、根据盐类水解原理知,组成盐的酸根对应的酸越弱该盐的水解程度越大,溶液的碱性越强,pH越大,测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,可判断硫酸的酸性大于碳酸,元素最高价氧化物水化物的酸性越强非金属性越强,进而判断碳与硫的非金属性强弱,正确。
考点:考查电解质溶液中的离子平衡。

已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表, 水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
(12分)在体积不变的2L密闭容器中,进行如下化学反应:CO2(g)+H2(g) 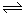 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃ | 500 | 600 | 800 | 900 | 1000 |
K | 0.5 | 0.6 | 1.0 | 1.3 | 1.5 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应正反应为_____反应(选填“吸热”“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:
3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为________。
(4)若800 ℃时,向容器中充入2 mol CO2、2 mol H2,反应进行到5min内,容器内CO的体积分数为20%,则用CO2表示的平均反应速率为 ,达到平衡后,CO2的转化率为 。
(5)800 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
| A、Ca2+、K+、HCO3-、OH- |
| B、Al3+、NH4+、CO32-、Cl- |
| C、Na+、Ba2+、OH-、NO3- |
| D、H+、NH4+、SO32-、NO3- |
