题目内容
下表是元素周期表的一部分,针对表中的①~⑩10种元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,最易失电子的元素是 ,非金属性最强的元素是 ;
(2)化学性质最不活泼的元素是 ,其原子的原子结构示意图为 ;
(3)元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ;(填写化学式)
(4)在③~⑦元素中,原子半径最大的是 ,原子半径最小的是 ;
(5)在⑦与⑩的单质中,氧化性强的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): .
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素是
(3)元素的最高价氧化物对应的水化物中酸性最强的是
(4)在③~⑦元素中,原子半径最大的是
(5)在⑦与⑩的单质中,氧化性强的是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①~⑩10种元素分别是N、F、Na、Mg、Al、Si、Cl、Ar、K、Br元素,
(1)在这些元素中,金属性最强的元素在周期表左下角、非金属性最强的元素在周期表右上角,金属性越强的元素越容易失电子,非金属性越强的元素越容易得电子;
(2)这些元素中,Ar元素化学性质最不活泼,其原子核外有3个电子层、最外层有8个电子,据此书写其原子结构示意图;
(3)元素的金属性越强,其最高价氧化物是水化物碱性越强,元素的非金属性越强,其最高价氧化物是水化物酸性越强,这些元素中呈两性的氢氧化物是Al(OH)3;
(4)同一周期元素,原子半径随着原子序数增大而减小;
(5)同一主族元素中,元素的非金属性随着原子序数增大而减弱,元素的非金属性越强,其单质的氧化性氧气,根据单质之间的置换反应判断氧化性强弱.
(1)在这些元素中,金属性最强的元素在周期表左下角、非金属性最强的元素在周期表右上角,金属性越强的元素越容易失电子,非金属性越强的元素越容易得电子;
(2)这些元素中,Ar元素化学性质最不活泼,其原子核外有3个电子层、最外层有8个电子,据此书写其原子结构示意图;
(3)元素的金属性越强,其最高价氧化物是水化物碱性越强,元素的非金属性越强,其最高价氧化物是水化物酸性越强,这些元素中呈两性的氢氧化物是Al(OH)3;
(4)同一周期元素,原子半径随着原子序数增大而减小;
(5)同一主族元素中,元素的非金属性随着原子序数增大而减弱,元素的非金属性越强,其单质的氧化性氧气,根据单质之间的置换反应判断氧化性强弱.
解答:
解:根据元素在周期表中的位置知,①~⑩10种元素分别是N、F、Na、Mg、Al、Si、Cl、Ar、K、Br元素,
(1)在这些元素中,金属性最强的元素是K元素,所以最易失电子的元素是K,非金属性最强的元素是F,故答案为:K;F;
(2)这些元素中,Ar元素化学性质最不活泼,其原子核外有3个电子层、最外层有8个电子,原子结构示意图为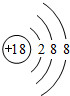 ,故答案为:
,故答案为: ;
;
(3)这几种元素中,F元素没有正化合价,其次非金属性最强的是Cl元素,所以酸性最强的酸是HClO4,金属性最强的是K元素,所以碱性最强的是KOH,这些元素中呈两性的氢氧化物是Al(OH)3,
故答案为:HClO4;KOH;Al(OH)3;
(4)同一周期元素,原子半径随着原子序数增大而减小,所以这几种元素中,原子半径最大的是Na、最小的是Cl元素,故答案为:Na;Cl;
(5)⑦与⑩非金属性较强的是Cl元素,所以单质氧化性较强的是Cl2,氯气能和溴化物溶液发生置换反应生成溴,反应方程式为Cl2+2NaBr=2NaCl+Br2,故答案为:Cl2;Cl2+2NaBr=2NaCl+Br2.
(1)在这些元素中,金属性最强的元素是K元素,所以最易失电子的元素是K,非金属性最强的元素是F,故答案为:K;F;
(2)这些元素中,Ar元素化学性质最不活泼,其原子核外有3个电子层、最外层有8个电子,原子结构示意图为
 ,故答案为:
,故答案为: ;
;(3)这几种元素中,F元素没有正化合价,其次非金属性最强的是Cl元素,所以酸性最强的酸是HClO4,金属性最强的是K元素,所以碱性最强的是KOH,这些元素中呈两性的氢氧化物是Al(OH)3,
故答案为:HClO4;KOH;Al(OH)3;
(4)同一周期元素,原子半径随着原子序数增大而减小,所以这几种元素中,原子半径最大的是Na、最小的是Cl元素,故答案为:Na;Cl;
(5)⑦与⑩非金属性较强的是Cl元素,所以单质氧化性较强的是Cl2,氯气能和溴化物溶液发生置换反应生成溴,反应方程式为Cl2+2NaBr=2NaCl+Br2,故答案为:Cl2;Cl2+2NaBr=2NaCl+Br2.
点评:本题考查了元素周期表和元素周期律综合应用,根据原子结构、物质结构及物质性质、元素周期律等知识来分析解答,熟练掌握并灵活运用元素周期律知识,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
同温同压下,相同质量的CO和CO2两气体相比较,下列叙述正确的是( )
①分子数之比为1:1 ②所含O原子数之比为11:14 ③体积之比为11:7 ④分子数之比为11:7.
①分子数之比为1:1 ②所含O原子数之比为11:14 ③体积之比为11:7 ④分子数之比为11:7.
| A、①③④ | B、①②④ |
| C、①②③ | D、②③④ |
合成氨反应N2+3H2
2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol?L-1?s-1)时,下列关系式中正确的是( )
| 高温高压 |
| 催化剂 |
| A、v(H2)=3v(N2) |
| B、v(N2)=2v(NH3) |
| C、v(NH3)=v(H2) |
| D、v(H2)=v(NH3) |

 如图表示的是向某NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸产生CO2的过程.请回答下列问题:
如图表示的是向某NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸产生CO2的过程.请回答下列问题: