题目内容
取含MnO2的软锰矿石25.0g,跟足量浓盐酸反应,制得5.6L标准状况下的氯气,已知反应后MnO2转化为MnCl2,杂质不与浓盐酸反应.计算:
(1)这种软锰矿石中MnO2的质量分数?
(2)被氧化的HCl为多少g?
(1)这种软锰矿石中MnO2的质量分数?
(2)被氧化的HCl为多少g?
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据n=
计算氯气的物质的量,结合方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O计算MnO2的物质的量,再根据m=nM计算MnO2的质量,进而计算软锰矿石中MnO2的质量分数;
(2)由Cl元素化合价变化可知,被氧化的HCl生成氯气,根据Cl原子守恒计算被氧化HCl的物质的量,再根据m=nM计算被氧化HCl的质量.
| V |
| Vm |
| ||
(2)由Cl元素化合价变化可知,被氧化的HCl生成氯气,根据Cl原子守恒计算被氧化HCl的物质的量,再根据m=nM计算被氧化HCl的质量.
解答:
解:(1)氯气的物质的量=
=0.25mol,
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
0.25mol 0.25mol
故MnO2的质量=0.25mol×87g/mol=21.75g,软锰矿石中MnO2的质量分数=
×100%=87%,
答:软锰矿石中MnO2的质量分数为87%;
(2)由Cl元素化合价变化可知,被氧化的HCl生成氯气,根据Cl原子守恒,被氧化HCl的物质的量=0.25mol×2=0.5mol,被氧化HCl的质量=0.5mol×36.5g/mol=18.25g,
答:被氧化的HCl的质量为18.25g.
| 5.6L |
| 22.4L/mol |
MnO2+4HCl(浓)
| ||
0.25mol 0.25mol
故MnO2的质量=0.25mol×87g/mol=21.75g,软锰矿石中MnO2的质量分数=
| 21.75g |
| 25g |
答:软锰矿石中MnO2的质量分数为87%;
(2)由Cl元素化合价变化可知,被氧化的HCl生成氯气,根据Cl原子守恒,被氧化HCl的物质的量=0.25mol×2=0.5mol,被氧化HCl的质量=0.5mol×36.5g/mol=18.25g,
答:被氧化的HCl的质量为18.25g.
点评:本题考查化学方程式的计算、氧化还原反应计算,难度不大,侧重对基础知识的巩固,注意(2)中被氧化的HCl得到氯气,根据部分Cl原子守恒计算.

练习册系列答案
相关题目
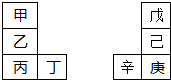 甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A、金属性:甲>乙>丁 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、乙的单质在空气中燃烧生成只含离子键的化合物 |
除去乙烷C2H6中混有的少量乙烯C2H4,选择方案合理是( )
| A、溴水、洗气 |
| B、高锰酸钾、洗气 |
| C、氢气、催化剂加成 |
| D、乙烷脱氢 |

 鉴别失去标签的氯化钡、碳酸钠和稀盐酸三种无色溶液.
鉴别失去标签的氯化钡、碳酸钠和稀盐酸三种无色溶液.