题目内容
20.在给定的条件下,下列选项中所示的物质间的转化均能一步实现的是( )| A. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| B. | AgNO3$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$ Ag | |
| C. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$ Mg |
分析 A.氮气和氢气反应生成氨气,氨气和氯化氢反应生成氯化铵;
B.蔗糖为非还原性糖,与银氨溶液不反应;
C.二氧化硅和氯化氢不能反应生成四氯化硅;
D.电解氯化镁溶液生成氢氧化镁、氯气和氢气.
解答 解:A.工业上用氢气与氮气在高温高压和催化剂的条件下反应合成氨,3H2+N2$?_{催化剂}^{高温高压}$2NH3,氨气通入氯化氢溶液中发生NH3+HCl=NH4Cl,所示的物质间的转化均能一步实现,故A正确;
B.蔗糖为非还原性糖,与银氨溶液不反应,故B错误;
C.二氧化硅是酸性氧化物和氯化氢不能反应生成四氯化硅,故C错误;
D.碳酸镁和盐酸反应生成氯化镁和二氧化碳、水,电解氯化镁溶液生成氢氧化镁、氯气和氢气,工业用电解熔融的氯化镁制备镁,故D错误;
故选A.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质以及转化的特点、反应条件,难度不大,注意相关基础知识的积累.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
10.以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氧化锌和金属锌.
Ⅰ.制取氧化锌主要工艺如图1:
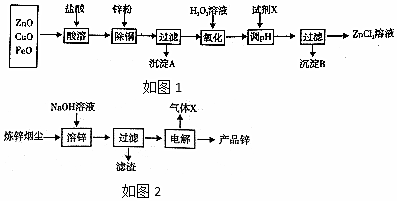
表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为l.0mol/L计算).
(1)为了加快反应,“酸溶”需要适当加热,但温度不宜太高,原因是减少盐酸挥发.
(2)加入H2O2溶液发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)流程图中,为了降低溶液的酸度,调节pH范围为3.2≤PH<5.2;若试剂X为Zn2(OH)2CO3,加入X除杂质的离子方程式为3Zn2(OH)2CO3+4Fe3++3H2O=4Fe(OH)3↓+6Zn2++3CO2↑.
(4)已知,室温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=3时,溶液中c(Fe3+)为4.0×10-5.从ZnCl2溶液中提取无水ZnCl2的方法是在氯化氢气体,蒸干氯化锌溶液并加热至失去结晶水.
Ⅱ.制取金属锌采用碱溶解ZnO(s)+2NaOH (aq)+H2O═Na2[Zn(OH)4](aq),然后电解浸取液.
(5)如图2,炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
(6)以石墨作电极电解时,阳极产生的气体为O2;阴极的电极反应为[Zn(OH)4]2-+2e-=Zn+4OH-.
Ⅰ.制取氧化锌主要工艺如图1:

表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为l.0mol/L计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
(2)加入H2O2溶液发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)流程图中,为了降低溶液的酸度,调节pH范围为3.2≤PH<5.2;若试剂X为Zn2(OH)2CO3,加入X除杂质的离子方程式为3Zn2(OH)2CO3+4Fe3++3H2O=4Fe(OH)3↓+6Zn2++3CO2↑.
(4)已知,室温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=3时,溶液中c(Fe3+)为4.0×10-5.从ZnCl2溶液中提取无水ZnCl2的方法是在氯化氢气体,蒸干氯化锌溶液并加热至失去结晶水.
Ⅱ.制取金属锌采用碱溶解ZnO(s)+2NaOH (aq)+H2O═Na2[Zn(OH)4](aq),然后电解浸取液.
(5)如图2,炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是氧化铜、氧化亚铁不溶于碱溶液中.
(6)以石墨作电极电解时,阳极产生的气体为O2;阴极的电极反应为[Zn(OH)4]2-+2e-=Zn+4OH-.
11.下列关于有机化合物的说法正确的是( )
| A. | 石油裂解和蛋白质水解都是由高分子化合物生成小分子物质的过程 | |
| B. | 乙烯分别使溴水和酸性KMnO4溶液褪色,反应原理相同 | |
| C. | C6H14有5种同分异构体 | |
| D. | CH4和Cl2按体积比1:3混合可制得纯净的CHCl3 |
8. 常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )
常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )
 常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )
常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示.反应过程中有红棕色气体产生.下列说法错误的是( )| A. | t1时刻前,A1片的电极反应为:2A1-6e-+3H2O═A12O3+6H+ | |
| B. | t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应 | |
| C. | t1之后,负极Cu失电子,电流方向发生改变 | |
| D. | 烧杯中发生的离子反应为:2NO2+2OH-═2NO3-+H2O |
15.有一种军用烟幕弹中装有ZnO、Al粉和C2Cl6,其发烟过程中的化学反应如下:
①3ZnO+2Al→Al2O3+3Zn ②3Zn+C2Cl6→3ZnCl2+2C
下列有关叙述不正确的是( )
①3ZnO+2Al→Al2O3+3Zn ②3Zn+C2Cl6→3ZnCl2+2C
下列有关叙述不正确的是( )
| A. | 反应①是铝热反应 | B. | 反应②是置换反应 | C. | C2Cl6属于卤代烃 | D. | 氧化性:Al<Zn<C |
4.醋酸在水中电离方程式可表示为:CH3COOH?CH3COO-+H+△H>0,下列操作能使H+浓度增大的是( )
| A. | 加入少量NaOH固体 | B. | 加热升温10℃ | ||
| C. | 加入锌粉 | D. | 加入固体CH3COONa |
11.下列事实不能用于判断元素金属性强弱的是( )
| A. | 金属间发生置换反应 | |
| B. | 金属元素的最高价氧化物对应水化物的碱性强弱 | |
| C. | 1mol金属单质在反应中失去电子的多少 | |
| D. | 金属元素的单质与水或酸反应置换出氢气的难易 |
8.下列对一些客观事实和理论解释正确的是( )
| 选项 | 事实 | 理论解释 |
| A | Na 与水反应失去 1 个电子,Mg 与水反应失去 2 个电子 | Na 的金属性比 Mg 强 |
| B | H2S 的还原性比 HCl | S 的非金属性比 Cl |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子 |
| D | Si 是半导体材料,同主族的 Ge 也 是半导体材料 | ⅣA 元素形成的单质都是半导体材料 |
| A. | A | B. | B | C. | C | D. | D |
9.常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液,含A元素的有关微粒的物质的量变化如图.根据图示判断,下列说法正确的是 ( )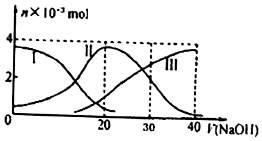

| A. | H2A在水中的电离方程式是:H2A═H++HA-、HA-?H++A2- | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+ )+c(HA- )+2c(H2A)═c(A2- )+2c(OH-) | |
| D. | 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c(OH-) |