题目内容
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A、溶液中一定不含有CO32-,可能含有SO42-和NO3- |
| B、溶液中的阳离子只有H+、Mg2+、Al3+ |
| C、溶液中n(NH4+)=0.2mol |
| D、n(H+):n(Al3+):n(Mg2+)=1:1:1 |
考点:常见阴离子的检验,常见阳离子的检验
专题:
分析:加锌产生无色无味气体说明锌与氢离子反应生成氢气,溶液中有大量氢离子,则没有碳酸根和硝酸根离子;
加氢氧化钠产生白色沉淀说明不含三价铁离子;
当溶液中含氢离子、铵根离子、镁离子、铝离子时,加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,结合图象沉淀的量与加入氢氧化钠的物质的量的关系解答.
加氢氧化钠产生白色沉淀说明不含三价铁离子;
当溶液中含氢离子、铵根离子、镁离子、铝离子时,加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,结合图象沉淀的量与加入氢氧化钠的物质的量的关系解答.
解答:
解:A.加锌产生无色无味气体说明锌与氢离子反应生成氢气,溶液中有大量氢离子,则没有碳酸根和硝酸根离子,因为硝酸根、氢离子与锌会反应生成刺激性的一氧化氮,故A错误;
B.加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,依据图象中沉淀量的变化曲线可知加入氢氧化钠0.5mol-0.7mol时,发生反应氨根离子与氢氧根离子反应,沉淀的量不变,所以溶液中的阳离子一定含NH4+、H+、Mg2+、Al3+,故B错误;
C.依据图象中沉淀量的变化曲线可知加入氢氧化钠0.5mol-0.7mol时,沉淀的量不变,发生反应氨根离子与氢氧根离子反应,依据NH4++OH-=NH3?H2O,氨根离子的物质的量等于该段消耗的氢氧化钠的物质的量等于0.2mol,故C正确;
D.第一段是氢氧化钠中和氢离子的阶段,所以氢离子的物质的量是0.1mol;第四段是氢氧化铝和氢氧化钠反应的阶段,即Al(OH)3~OH-~[Al(OH)4]-,则消耗氢氧化钠的物质的量为:0.8mol-0.7mol=0.1mol;第二段是将铝离子和镁离子反应生成沉淀的阶段,根据Al3+~3OH-~Al(OH)3,Mg2+~2OH-~Mg(OH)2,0.1mol氢氧化铝消耗氢氧化钠的物质的量是0.3mol,所以镁离子消耗氢氧化钠的物质的量是:0.5mol-0.1mol-0.3mol=0.1mol,所以镁离子的物质的量是0.05mol,即n(H+):n(Al3+):n(Mg2+)=0.1:0.1:0.05=2:2:1,故D错误;
故选:C.
B.加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠,依据图象中沉淀量的变化曲线可知加入氢氧化钠0.5mol-0.7mol时,发生反应氨根离子与氢氧根离子反应,沉淀的量不变,所以溶液中的阳离子一定含NH4+、H+、Mg2+、Al3+,故B错误;
C.依据图象中沉淀量的变化曲线可知加入氢氧化钠0.5mol-0.7mol时,沉淀的量不变,发生反应氨根离子与氢氧根离子反应,依据NH4++OH-=NH3?H2O,氨根离子的物质的量等于该段消耗的氢氧化钠的物质的量等于0.2mol,故C正确;
D.第一段是氢氧化钠中和氢离子的阶段,所以氢离子的物质的量是0.1mol;第四段是氢氧化铝和氢氧化钠反应的阶段,即Al(OH)3~OH-~[Al(OH)4]-,则消耗氢氧化钠的物质的量为:0.8mol-0.7mol=0.1mol;第二段是将铝离子和镁离子反应生成沉淀的阶段,根据Al3+~3OH-~Al(OH)3,Mg2+~2OH-~Mg(OH)2,0.1mol氢氧化铝消耗氢氧化钠的物质的量是0.3mol,所以镁离子消耗氢氧化钠的物质的量是:0.5mol-0.1mol-0.3mol=0.1mol,所以镁离子的物质的量是0.05mol,即n(H+):n(Al3+):n(Mg2+)=0.1:0.1:0.05=2:2:1,故D错误;
故选:C.
点评:本题考查了离子的检验和有关离子方程式的计算,明确图象中各段发生的反应是解题关键,题目难度中等.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案
相关题目
下列关于反应4Li+2SOC12═4LiCl+S+SO2的叙述中,不正确的是( )
| A、SOCl2是氧化剂,Li是还原剂 |
| B、2 mol SOCl2参加反应,共转移4 mol电子 |
| C、将该反应设计成电池,SOCl2在正极发生反应 |
| D、若将该反应设计成电池,可用稀硫酸作电解质溶液 |
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=8.0×10-38,Kb(NH3?H2O)=1.8×10-5,下列叙述中不正确的是( )
| A、25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀 |
| B、25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂 |
| C、25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强 |
| D、25℃时,NH4++H2O?NH3?H2O+H+的平衡常数为5.6×10-10 |
一定温度下,在体积为10L的密闭容器中充满NH3,进行如下反应:2NH3(g)?3H2(g)+N2(g);经5s达到平衡,平衡时NH3和H2的浓度均为bmol/L.下列叙述中不正确的是( )
A、NH3在5s内的平均速度为
| ||
| B、达到平衡时NH3的分解率为40% | ||
C、N2的平衡浓度为
| ||
| D、反应开始时与平衡时的压强比为5:7 |
化学与人类生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A、氮氧化合物与碳氢化合物经紫外线照射可发生反应形成有毒烟雾 |
| B、绿色化学的核心是应用化学原理对环境污染进行治理 |
| C、雾霾中含有大量超标的主要物质是二氧化硫 |
| D、食盐中的Na+的焰色反应呈黄色,属于化学变化 |
 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: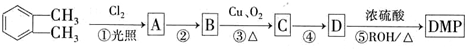
 的名称
的名称 制备DMP的另一种途径:
制备DMP的另一种途径:

 某小组以CoCl2?6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2?6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.