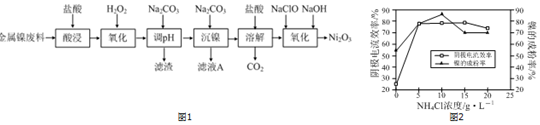
题目内容
1.现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种.(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是K2CO3和Ba(OH)2.
(2)物质C中含有离子X.为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为B(填字母).
A.Br- B.SO42- C.CH3COO- D.HCO3-
(3)将19.2g Cu投入装有足量D溶液韵试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,若要将Cu完全溶解,至少加入H2SO4的物质的量是0.4mol.
(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为2Fe3++2I-=2Fe2++I2.
分析 CO32-与Fe3+、Cu2+、Ba2+、Al3+不能大量共存,OH-与Fe3+、Cu2+、Al3+不能大量共存;则必有的两种物质记为A、B,A、B分别为K2CO3、Ba(OH)2,C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,蓝色沉淀为氢氧化铜,白色沉淀为硫酸钡,则A应为Ba(OH)2,C中含SO42-,则C为CuSO4,D为Al(NO3)3,E为FeCl3,以此解答该题.
解答 解:(1)由上述分析可知,必有的两种物质为K2CO3、Ba(OH)2,
故答案为:K2CO3;Ba(OH)2;
(2)由上述分析可知,C为CuSO4,C中X为SO42-,
故答案为:B;
(3)根据以上推断可知D中含有NO3-,已知将19.2gCu投入装有足量D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,
发生的反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
则n(Cu)=mM=$\frac{19.2g}{64g/mol}$=0.3mol,
有方程可知$\frac{3}{8}$=$\frac{0.3mol}{n({H}^{+})}$,
所以n(H+)=0.8mol,
所以n(H2SO4)=12n(H+)=0.4mol,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;0.4mol;
(4)E为FeCl3,E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2.
点评 本题综合性较强,涉及无机物推断、离子检验、离子方程式的书写等,为高考常见题型,需要学生熟练掌握基础知识,有利于考查学生的推理能力,难度中等.

练习册系列答案
相关题目
16. 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠混合溶液 | 立即产生气泡 |
| B | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| C | 氯化铁溶液 | 淀粉碘化钾溶液 | 溶液变为蓝色 |
| D | 硫酸亚铁溶液 | 过氧化钠固体 | 产生气泡和白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
6.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如表所示:
由此判断:
(1)溶液中肯定存在的离子有:NO3-、SO42-、Mg2+、Al3+、Cl-,液中肯定不存在的离子有:I-、Ba2+、Fe2+、HCO3-,还需进一步实验才能确定是否存在K+. (填离子符号)
(2)请写出步骤b中溶液中所发生的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
| 实验步骤 | 实验现象 |
| a.取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| b.取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| c.取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| d.取少量该溶液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| e.取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子有:NO3-、SO42-、Mg2+、Al3+、Cl-,液中肯定不存在的离子有:I-、Ba2+、Fe2+、HCO3-,还需进一步实验才能确定是否存在K+. (填离子符号)
(2)请写出步骤b中溶液中所发生的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
13.从宏观现象探究微观本质是重要的化学学科素养.以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性.实验如图1:

(1)①中反应的离子方程式是3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+.
(2)②中逸出的无色气体是CO2.从物质类别的角度分析,Na2CO3与Na2SO3在化学性质方面的共性是两者都为强碱弱酸盐,能与强酸反应(写一条);从化合价的角度分析,Na2CO3与Na2SO3在化学性质方面的差异是Na2CO3中碳原子为最高正价+4,无还原性;Na2SO3中硫原子+4价,具有较强的还原性(写一条).
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀.甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的.其实验方案是取③中的红棕色溶液少许,滴加铁氰化钾溶液,出现蓝色沉淀.
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
Ⅰ.⑤的实验目的是排除加水稀释对溶液颜色变化的影响.
Ⅱ.为探究④中溶液变无色的原因,进行如图2实验:(资料显示:FeF3溶液为无色.)用平衡移动原理解释红褐色沉淀产生的原因无色溶液中存在平衡:Fe3++3F-?FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与碱性物质的pH、离子的性质有关.

(1)①中反应的离子方程式是3Mg(OH)2+2Fe3+=2Fe(OH)3(胶体)+3Mg2+.
(2)②中逸出的无色气体是CO2.从物质类别的角度分析,Na2CO3与Na2SO3在化学性质方面的共性是两者都为强碱弱酸盐,能与强酸反应(写一条);从化合价的角度分析,Na2CO3与Na2SO3在化学性质方面的差异是Na2CO3中碳原子为最高正价+4,无还原性;Na2SO3中硫原子+4价,具有较强的还原性(写一条).
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀.甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的.其实验方案是取③中的红棕色溶液少许,滴加铁氰化钾溶液,出现蓝色沉淀.
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
| 实验操作及现象 | ④向2mL 0.2mol/L FeCl3溶液中滴入2mL1mol/L NaF溶液,溶液变无色. |
| ⑤向2mL 0.2mol/L FeCl3溶液中滴入2mL 蒸馏水,溶液颜色变浅. |
Ⅱ.为探究④中溶液变无色的原因,进行如图2实验:(资料显示:FeF3溶液为无色.)用平衡移动原理解释红褐色沉淀产生的原因无色溶液中存在平衡:Fe3++3F-?FeF3,加入NaOH后,Fe3+更易与OH-结合生成难溶的Fe(OH)3
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与碱性物质的pH、离子的性质有关.
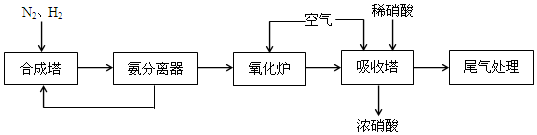
 2NH3,该反应中的氧化剂是N2.
2NH3,该反应中的氧化剂是N2.