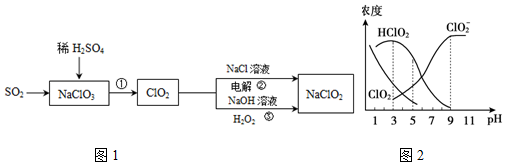
题目内容
17.NH3和HNO3是重要的工业产品,下图为合成氨以及氨氧化制硝酸的流程.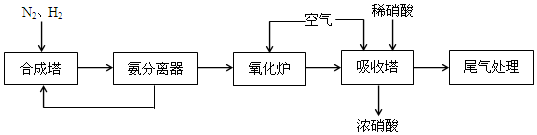
(1)N2约占空气体积的78%,从空气中分离出N2利用的原理是液氨和液氧的沸点不同.
(2)合成塔中发生反应的化学方程式是N2+3H2
 2NH3,该反应中的氧化剂是N2.
2NH3,该反应中的氧化剂是N2.22.4LN2(标准状况)完全反应时,转移电子的物质的量是6mol.
(3)氧化炉中发生反应的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(4)吸收塔中通入空气的作用是将NO氧化为NO2.
分析 (1)根据空气中各种组成成分的含量进行分析、判断,根据空气中各种气体的沸点不同,可以进行分离.分离前首先进行除尘,除去二氧化碳和水蒸气,蒸发液态空气首先的到的是氮气;
(2)合成塔中氮气和氢气反应生成氨气,该反应为可逆反应;在氧化还原反应中,元素的化合价降低的反应物为氧化剂,根据N2量计算转移电子数;
(3)氧化炉中氨的催化氧化,产物是一氧化氮和水,据此得失电子守恒书写反应方程式;
(4)吸收塔中通入空气的作用是使NO全部转化为NO2.
解答 解:(1)空气中,N2约占空气体积的78%,O2约占空气体积的21%,在除去空气中的灰尘、二氧化碳和水蒸气后,液化空气,控制条件,氮气的沸点比氧气的沸点低,蒸发液态空气首先的到的是氮气,再把氮气和氧气分离,
故答案为:78%,液氨和液氧的沸点不同;
(2)合成塔中氮气和氢气反应,在高温高压的条件下反应生成氨气,反应方程式为:N2+3H2  2NH3,在该反应中,N元素的化合价降低(0→-3),N2为氧化剂,1mol氮气转移6mol电子,22.4LN2(标准状况)物质的量为1mol,完全反应时,转移6mol电子,
2NH3,在该反应中,N元素的化合价降低(0→-3),N2为氧化剂,1mol氮气转移6mol电子,22.4LN2(标准状况)物质的量为1mol,完全反应时,转移6mol电子,
故答案为:N2+3H2  2NH3;N2;6mol;
2NH3;N2;6mol;
(3)氧化炉中发生的反应是氨的催化氧化反应,反应中N元素化合价由NH3中-3价升高为NO中+2价,共升高5价,O元素由O2中0价降低为-2价,共降低4价,化合价升降最小公倍数为20,故NH3系数为4,故O2系数为5,利用元素守恒平衡可知NO系数为4,H2O的系数为6,方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
(4)氧化炉中出来的气体,先降温再进入吸收塔,吸收塔中通入空气发生反应2NO+O2=2NO2,所以吸收塔中通入空气的作用是将NO氧化为NO2,
故答案为:将NO氧化为NO2.
点评 本题主要考查了合成氨工业,题目难度不大,掌握合成氨工业的流程,掌握氮及其化合物的性质是解答本题的关键,综合考查了学生具有分析和解决问题的能力.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案| A. | 阴离子的半径:Y>W | |
| B. | 气态氢化物稳定性:Y>Z | |
| C. | 最外层电子数:Y=Z | |
| D. | X、Y、Z中的两种元素形成的化合物在常温下都为气体 |
| A. | 铝镁合金的硬度较大,钠钾合金的硬度较小 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜溶液中的铜,钠也能置换硫酸铜溶液中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,氧在产物中的化合价都是-2 |
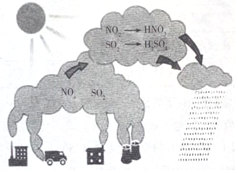
| A. | 图示过程表示了地球臭氧层的破坏过程 | |
| B. | 图中涉及的氧化物均为酸性氧化物 | |
| C. | 机动车尾气含有N的氧化产物 | |
| D. | 图示中描述的过程所涉及的反应均为氧化还原反应 |
| A. | 一定有Fe2+和Cu2+ | B. | 一定有Fe2+,Cu2+,可能有Fe3+ | ||
| C. | 一定有Fe2+,可能有Cu2+ | D. | 只有Fe2+ |
 太原市自2016年11月1日零时起,将汽车用油全部更换为”国V标准”车用燃料,进而 改善太原市空气质量.下列物质中,不会造成空气污染的是( )
太原市自2016年11月1日零时起,将汽车用油全部更换为”国V标准”车用燃料,进而 改善太原市空气质量.下列物质中,不会造成空气污染的是( )