题目内容
3.有关AgCl沉淀的溶解平衡说法正确的是( )| A. | AgCl沉淀生成和沉淀溶解不断进行,但速率相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 在AgCl沉淀溶解平衡体系中加入蒸馏水,AgCl的Ksp增大 | |
| D. | AgCl在相同浓度的CaCl2和NaCl溶液中的溶解度相同 |
分析 A、沉淀溶解平衡是动态平衡;
B、AgCl难溶于水,溶解度很小,但是不为零;
C、溶度积只与温度有关;
D、氯离子浓度不同,根据同离子效应,白色AgCl的溶解度不同.
解答 解:A、达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,是动态平衡,速率相等但是不为零,故A正确;
B、AgCl难溶于水,溶解度很小,但是不为零,所以溶液中含有少量的Ag+和Cl-,达到沉淀溶解平衡时,故B错误;
C、溶度积只与温度有关,在AgCl沉淀溶解平衡体系中加入蒸馏水,AgCl的Ksp不变,故C错误;
D、相同浓度的CaCl2和NaCl溶液中氯离子浓度不同,根据同离子效应,白色AgCl的溶解度不同,故D错误;
故选A.
点评 本题主要考查了沉淀溶解平衡的影响因素和平衡移动方向,物质溶解度的变化应用,题目较简单,平时注意认真总结.

练习册系列答案
相关题目
12.某温度下,在容积不变的密闭容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol和4mol,保持温度和容积不变,对平衡混合物中三者的物质的量做如下调整,A的转化率降低的是( )
| A. | 均加倍 | B. | 加入1mol C | C. | 均增加1mol | D. | 均减半 |
11.下列离子方程式正确的是( )
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Mg(OH)2溶于硝酸:OH-+H+=H2O | |
| C. | Al与NaOH溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
18.下列说法不正确的是( )
| A. | 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 | |
| B. | 0.1mol•L-1的NaHCO3溶液中C(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.1mol•L-1的NaHA溶液pH=5,则溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) | |
| D. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 |
8.下列物质中既存在离子键又存在共价键的是( )
| A. | K2S | B. | NaOH | C. | SiO2 | D. | CO2 |
15.将海水淡化我浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.
回答下列问题:
(1)海水淡化的方法主要是②(填序号).
①过滤 ②蒸馏 ③萃取 ④蒸发
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O=NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时,转移的电子数为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,产品2的化学式为Mg(OH)2.1L浓海水最多可得到产品2的质量为69.6g.
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
回答下列问题:
(1)海水淡化的方法主要是②(填序号).
①过滤 ②蒸馏 ③萃取 ④蒸发
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O=NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时,转移的电子数为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:

浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
12.下列措施或工艺中,有利于节能的是( )
| A. | 利用铝热反应大规模冶炼钢铁 | |
| B. | 用一氧化碳高温还原氧化铝提纯铝 | |
| C. | 西汉时期我国就采用“湿法冶铜”术 | |
| D. | 利用高温分解硫酸钙得到的二氧化硫制备硫酸 |
13.某电池的总反应的离子方程式为2Fe3++Fe═3Fe2+,正极、负极和电解质溶液依次如下,不能实现该反应的原电池组合是( )
| A. | Cu Fe FeCl3 | B. | C Fe Fe(NO3)3 | ||
| C. | Fe Zn Fe2(SO4)3 | D. | Ag Fe Fe2(SO4)3 |
 ,其一氯代物的结构简式是
,其一氯代物的结构简式是 ;其中一氯代物种类最多的是
;其中一氯代物种类最多的是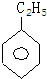 .(均填结构简式)
.(均填结构简式)