题目内容
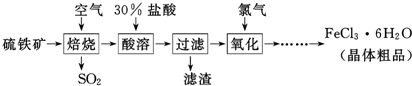
13.实验室以空气(O2体积分数20%)为原料,在无碳、无水的环境下,用下图A装置制备臭氧(3O2$\frac{\underline{\;放电\;}}{\;}$2O3).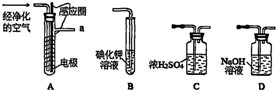
(1)空气通入A装置之前,应先后通过上述装置中的D、C(填装置序号).
(2)臭氧与碘化钾溶液反应为:2KI+O3+H2O=2KOH+I2+O2.将a处气体通入装置B,溶液中的现象为溶液出现紫红色.
(3)为测定O2转化为O3的转化率,将装置B中的溶液全部转入另一容器中,加入CC14,经萃取、分液、蒸馏、冷却、称重,得I2固体0.254g.
①萃取操作所用玻璃仪器的名称分液漏斗.
②若实验时通入空气1.12L(标准状况),O2的转化率为15%.
③测定时需在A、B装置间连接装置D,原因是除去臭氧中的氮的氧化物.
(4)工业上分离O3和O2,可将混合气体液化后再分离,下列分离方法合理的是B(填序号).
A.过滤 B.分馏 C.分液 D.萃取
(5)臭氧可用于含CN一碱性电镀废水的处理.第i步:CN一转化为OCN-;第ii步:OCN一继续转化为CO32一及两种单质气体.若第ii步转化时,O3与OCN-物质的质量之比为3:2,该步反应的离子方程式为2OH-+3O3+2OCN-=2CO32-+N2+3O2+H2O.
分析 (1)O2在无碳、无水的环境下制备臭氧,所以空气中的水和二氧化碳要先除去;
(2)O3将碘化钾氧化成碘,据此判断碘化钾溶液的颜色变化;
(3)①萃取实验中要用分液漏斗;
②根据关系式I2~03~$\frac{3}{2}$O2,可计算出转化了的氧气的物质的量,根据转化率=$\frac{消耗量}{起始量}$×100%计算;
③在放电条件下,空气中的氧气有可能与氮气产生氮的氧化物,这些氮的氧化物能氧化碘化钾,所以要除去;
(4)由于03和02的沸点不同,所以可将混合气体液化后再分馏的方法进行分离;
(5)OCN一继续转化为CO32一及两种单质气体,这两种单质应为氮气和氧气,当O3与OCN-物质的质量之比为3:2时,根据电荷守恒可写出离子方程式.
解答 解:(1)O2在无碳、无水的环境下制备臭氧,空气中的水和二氧化碳要先除去,所以空气通入A装置之前,应先后通过上述装置中的D和C,
故答案为:D;C;
(2)O3将碘化钾氧化成碘,无色的碘化钾溶液会出现紫红色,
故答案为:溶液出现紫红色;
(3)①萃取实验中要用分液漏斗,
故答案为:分液漏斗;
②当I2固体0.254g即0.001mol时,根据关系式I2~03~$\frac{3}{2}$O2,可知参加反应的氧气的物质的量为0.0015mol,实验时通入空气1.12L即0.05mol,其中氧气的物质的量为0.01mol,所以O2的转化率为 $\frac{0.0015mol}{0.01mol}$×100%=15%,
故答案为:15%;
③在放电条件下,空气中的氧气有可能与氮气产生氮的氧化物,这些氮的氧化物能氧化碘化钾,所以测定时需在A,B装置间连接装置D,
故答案为:除去臭氧中的氮的氧化物;
(4)由于03和02的沸点不同,所以可将混合气体液化后再分馏的方法进行分离,故选B,
故答案为:B;
(5)OCN-继续转化为CO32-及两种单质气体,这两种单质应为氮气和氧气,当O3与OCN-物质的质量之比为3:2时,反应的离子方程式为:2OH-+3O3+2OCN-=2CO32-+N2+3O2+H2O,
故答案为:2OH-+3O3+2OCN-=2CO32-+N2+3O2+H2O.
点评 本题主要考查了物质的制备,除杂和提纯,题目难度中等,注意利用题目信息分析问题,培养了学生解决问题的能力.

| A. | 导电性好 | B. | 不易生锈 | C. | 光泽度好 | D. | 强度高 |
| A. | 溶液中含有2mol K2SO4 | B. | 可将2mol K2SO4溶于1L水中制得 | ||
| C. | 溶液中c(K+ )=4 mol•L-1 | D. | 1L 溶液中含4molK+,4molSO42- |
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.9kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-241.8kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=+285.9kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+241.8kJ/mol |
步骤II 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时,用去NaOH标准溶液的体积将无影响(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
已知:①连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②4HCl+2Na2S2O4═4NaCl+S↓+3SO2↑+2H2O

I. 制备Na2S2O4
75℃时,将甲酸钠和纯碱加入乙醇水溶液溶解后,再加入装置C中,然后通入SO2进行反应,其反应方程式为:2HCOONa+Na2CO3+4SO2═2Na2S2O4+3CO2+H2O.
分析并回答下列问题:
(1)A中盛装浓硫酸的仪器名称是分液漏斗
(2)A 中反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O; 冷却至 40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
(3)装置 D 盛放品红溶液,作用是检验装置C中SO2的吸收效率,若在吸收过程中D中颜色逐渐褪去,此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率.
II. Na2S2O4的性质
取纯净的Na2S2O4晶体,配成溶液,进行下列性质探究实验,完成如表的空格.
(供选择的试剂:淀粉-KI 溶液、紫色石蕊试液、稀硝酸、BaCl2溶液)
| 假 设 | 操 作 | 现 象 | 原 理 |
| Na2S2O4为强碱弱酸盐,其溶液为碱性. | 取少量溶液于试管中,滴加 ②紫色石蕊试液 | 溶液变成蓝色 | S2O42-水解,使溶液成碱性 |
| ①Na2S2O4具有还原性 | 取少量溶液于试管中,滴加过量新制氯水,再滴加 BaCl2 溶液 | 有白色沉淀生成 | 该反应的离子方程式依次为:③4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+,④Ba2++SO42-=BaSO4↓ |
取8.00g制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥.得固体0.64g.则 Na2S2O4的纯度为87%.[已知:M(Na2S2O4)=174.0g/mol].