题目内容
A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大.已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水.D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个.请回答下列问题:
(1)写出B的元素符号 ,E和F形成的某种化合物中原子均达到稳定结构,其电子式为 .
(2)若构成D元素的一种原子的质量数为30,写出其原子符号
(3)A与C、C与F元素最高价氧化物的水化物反应的离子方程式依次为: 、 .
(1)写出B的元素符号
(2)若构成D元素的一种原子的质量数为30,写出其原子符号
(3)A与C、C与F元素最高价氧化物的水化物反应的离子方程式依次为:
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D、E、F六种元素,它们的核电荷数均小于18,均处于短周期,原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;E、F的原子序数大于D,则E、F处于第三周期,E元素原子次外层电子数比最外层电子数多3,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,据此解答.
解答:
解:A、B、C、D、E、F六种元素,它们的核电荷数均小于18,均处于短周期,原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;E、F的原子序数大于D,则E、F处于第三周期,E元素原子次外层电子数比最外层电子数多3,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,
(1)由上面的分析可知,B为Mg元素,E和F形成的某种化合物中原子均达到稳定结构,该化合物为PCl3,其电子式为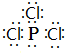 ,
,
故答案为:Mg;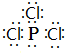 ;
;
(2)若构成Si元素的一种原子的质量数为30,其原子符号为3014Si,
故答案为:3014Si;
(3)氢氧化钠与氢氧化铝、氢氧化铝与高氯酸反应的离子方程式依次为:OH-+Al(OH)3═AlO2-+2H2O、3H++Al(OH)3═Al3++3H2O,
故答案为:OH-+Al(OH)3═AlO2-+2H2O、3H++Al(OH)3═Al3++3H2O.
(1)由上面的分析可知,B为Mg元素,E和F形成的某种化合物中原子均达到稳定结构,该化合物为PCl3,其电子式为
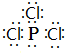 ,
,故答案为:Mg;
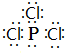 ;
;(2)若构成Si元素的一种原子的质量数为30,其原子符号为3014Si,
故答案为:3014Si;
(3)氢氧化钠与氢氧化铝、氢氧化铝与高氯酸反应的离子方程式依次为:OH-+Al(OH)3═AlO2-+2H2O、3H++Al(OH)3═Al3++3H2O,
故答案为:OH-+Al(OH)3═AlO2-+2H2O、3H++Al(OH)3═Al3++3H2O.
点评:本题考查结构性质位置关系、常用化学用语等,难度不大,注意基础知识的理解掌握,推断元素是解题的关键.

练习册系列答案
相关题目
 在密闭容器中,5mol H2与2mol CO2发生反应:3H2(g)十CO2(g)≒CH3OH(g)+H2O(g)反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示下列说法错误的是( )
在密闭容器中,5mol H2与2mol CO2发生反应:3H2(g)十CO2(g)≒CH3OH(g)+H2O(g)反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示下列说法错误的是( )| A、P1>P2>P3>P4 |
| B、甲醇的物质的量分数越高,反应的平衡常数越大 |
| C、若T1>T2>T3>T4,则该反应为放热反应 |
| D、T4、P4时,H2的平衡转化率为60% |
化学在日常生活中有着重要的应用袁下列说法中正确的是( )
| A、地沟油的主要成分是高级脂肪酸甘油酷,可用于制肥皂和加工食用油 |
| B、棉、麻、丝、毛及合成纤维完全燃烧都只生成C02和H20,对环境不会有影响 |
| C、BaSO4在医学上用作钡餐,Ba2+对人体无毒 |
| D、“落汤螃蟹着红袍”肯定发生了化学变化 |
下列分子中所有原子都满足最外层8电子结构的是( )
| A、PCl5 |
| B、HClO |
| C、PCl3 |
| D、BF3 |
 1个,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
1个,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构) 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色. (三聚氰胺)
(三聚氰胺) ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取 是电石的晶胞示意图,则一个晶胞中含有
是电石的晶胞示意图,则一个晶胞中含有