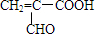题目内容
20.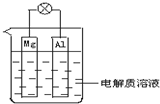 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):(1)电解质溶液为稀H2SO4时,灯泡亮(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).a.若灯泡亮,则Al电极上发生的反应为:2H++2e-=H2.b.若灯泡不亮,其理由为:此空不做.
(2)电解质溶液为NaOH(aq)时,灯泡亮(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).a.若灯泡亮,则Mg电极上发生的反应为:6H2O+6e-=3H2+6OH-;Al电极上发生的反应为:2Al-6e-+2OH-=2AlO2+6H2O.b.若灯泡不亮,其理由为:此空不做.
分析 (1)Mg、Al和稀硫酸构成原电池,有电流通过,所以灯泡会亮,Mg易失电子作负极,Al作正极,正极上氢离子得电子发生还原反应;
(2)该装置能自发的进行氧化还原反应,所以Mg、Al和NaOH溶液构成原电池,Al易失电子而作负极、Mg作正极,该装置将化学能转化为电能,所以灯泡亮.
解答 解:(1)Mg、Al和稀硫酸构成原电池,有电流通过,所以灯泡会亮,Mg易失电子作负极、Al作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,
故答案为:亮;2H++2e-=H2↑;
(2)该装置中,铝能和氢氧化钠溶液发生氧化还原反应,该装置符合原电池构成条件,所以Mg、Al和NaOH溶液构成原电池,则灯泡亮;Mg作正极,正极上水得电子生成氢气,正极的电极反应为:6H2O+6e-=3H2+6OH-,Al易失电子作负极,负极上电极反应式为2Al-6e-+2OH-=2AlO2+6H2O,
故答案为:亮;6H2O+6e-=3H2+6OH-;2Al-6e-+2OH-=2AlO2+6H2O.
点评 本题考查了原电池原理,明确原电池正负极的判断方法是解本题关键,知道原电池设计方法,注意:不能根据金属的活泼性强弱判断正负极,要根据失电子难易程度判断正负极,为易错点.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
8.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 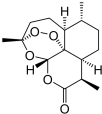 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
15.二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别是:
由上述数据可推断,熔点为-54℃的二甲苯的名称是( )
| 一溴代二甲苯 | 234℃ | 20℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
| 对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
| A. | 邻二甲苯 | B. | 间二甲苯 | C. | 对二甲苯 | D. | 无法确定 |
5.铝和氧化铁在高温下发生的反应中,铝是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既不是氧化剂又不是还原剂 | D. | 既是氧化剂又是还原剂 |
12.在Fe+CuSO4═FeSO4+Cu反应中,CuSO4是氧化剂;Fe是还原剂;Fe元素被氧化;Cu元素被还原;FeSO4是氧化产物;Cu是还原产物,具有氧化性的是CuSO4;具有还原性的是Fe.
9.下列各组物质中,所含分子数相等的是( )
| A. | 10gH2和10gCO | B. | 11.2LCO(标准状况)和22gCO2 | ||
| C. | 18gH2O和44gCO2 | D. | 22.4LH2和0.1molN2 |
10.下列叙述正确的是( )
| A. | 二氯甲烷有两种同分异构体 | |
| B. | 苯和苯的同系物均能使酸性高锰酸钾溶液褪色 | |
| C. | 用核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 一定条件下,溴乙烷既能发生取代反应又能发生消去反应 |
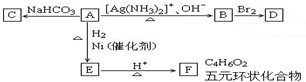 根据图示填空:(已知A分子式为${C_4}H_4^{\;}{O_3}$)
根据图示填空:(已知A分子式为${C_4}H_4^{\;}{O_3}$)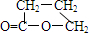 +H2O
+H2O