题目内容
下列描述中,不正确的是( )
| A、FeSO4可用于防止食品氧化变质,延长食品的保质期 |
| B、向FeSO4中加入NaOH溶液,观察到有灰白色的沉淀生成,灰白色的沉淀迅速变成灰绿色,最后变成红褐色 |
| C、向Fe2(SO4)3溶液中加入足量铁粉,充分反应后滴加KSCN溶液,溶液马上变成血红色 |
| D、铁在氧气中燃烧,生成黑色的Fe3O4 |
考点:铁盐和亚铁盐的相互转变,二价Fe离子和三价Fe离子的检验
专题:元素及其化合物
分析:A.防氧化就是防止食品发生氧化反应,应加入具有还原性物质;
B.FeSO4溶液滴入NaOH溶液,生成白色絮状沉淀是氢氧化亚铁沉淀,白色氢氧化亚铁在水中不稳定,容易跟水中的氧气反应生成红褐色的氢氧化铁;
C.三价铁与硫氰酸钾显血红色,二价铁离子与硫氰酸钾没有明显显现;
D.依据铁与氧气反应的产物判断.
B.FeSO4溶液滴入NaOH溶液,生成白色絮状沉淀是氢氧化亚铁沉淀,白色氢氧化亚铁在水中不稳定,容易跟水中的氧气反应生成红褐色的氢氧化铁;
C.三价铁与硫氰酸钾显血红色,二价铁离子与硫氰酸钾没有明显显现;
D.依据铁与氧气反应的产物判断.
解答:
解:A.FeSO4具有还原性,可用于防止食品氧化变质,延长食品的保质期,故A正确;
B.FeSO4溶液滴入NaOH溶液,生成白色絮状沉淀是氢氧化亚铁沉淀,白色氢氧化亚铁在水中不稳定,容易跟水中的氧气反应生成红褐色的氢氧化铁,故B正确;
C.向Fe2(SO4)3溶液中加入足量铁粉反应生成二价铁离子,二价铁离子与硫氰酸钾没有明显现象,故C错误;
D.铁能够在氧气中燃烧,反应生成四氧化三铁,故D正确;
故选:C.
B.FeSO4溶液滴入NaOH溶液,生成白色絮状沉淀是氢氧化亚铁沉淀,白色氢氧化亚铁在水中不稳定,容易跟水中的氧气反应生成红褐色的氢氧化铁,故B正确;
C.向Fe2(SO4)3溶液中加入足量铁粉反应生成二价铁离子,二价铁离子与硫氰酸钾没有明显现象,故C错误;
D.铁能够在氧气中燃烧,反应生成四氧化三铁,故D正确;
故选:C.
点评:本题考查了二价铁离子与三价铁离子的性质,题目难度不大,熟悉铁及其化合物的性质是解题关键,注意二价铁离子与三价铁离子的检验是高考的热点.

练习册系列答案
相关题目
常温下,0.1mol?L-1某一元碱(AOH)溶液中
=1×108,下列说法正确的是( )
| C(OH-) |
| C(H+) |
| A、该一元碱(AOH)溶液的pH=13 |
| B、该溶液中水电离出的C(OH-)=10-3 mol?L-1 |
| C、将pH=1的盐酸溶液V1 L与0.1 mol?L-1 AOH溶液V2 L混合,若混合溶液pH=7,则V1=V2 |
| D、将pH=1的盐酸溶液V1L与0.1 mol?L-1 AOH溶液V2 L混合,若混合溶液pH>7,则溶液中离子浓度由大到小的顺序可能为C(A+)>C(Cl-)>C(OH-)>C(H+) |
下列说法中正确的是( )
| A、在电解池中,与电源正极相连的电极是阴极 |
| B、在电解池中,物质在阴极发生氧化反应 |
| C、在原电池中,物质在负极发生氧化反应 |
| D、在原电池中,电子在正极流向负极 |
下列关于有机物的说法正确的是( )
| A、乙醇和乙酸能发生酯化反应,只要一种反应物过量酯化反应就能进行彻底 |
| B、乙醇、乙酸和乙酸乙酯三者的混合液可用分液的方法将三者分离 |
| C、煤的气化和煤的干馏都发生了化学变化,而石油的分馏属于物理变化 |
| D、苯不能使酸性高锰酸钾溶液褪色,因此苯不能发生氧化反应 |
在下列反应中:aFeS+bH2SO4(浓)→cFe2(SO4)3+dSO2+eS↓+6H2O,a、b数值是( )
| A、a=2,b=6 |
| B、a=4,b=18 |
| C、a=6,b=16 |
| D、a=8,b=18 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:SnCl2+Cl-+H3AsO3+H+--As+SnCl62-+M(未配平),关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成0.1mol的As,还原剂失去的电子为0.3mol ④M为OH-⑤SnCl62-是氧化产物 ⑥H+前面的配平系数为6.
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成0.1mol的As,还原剂失去的电子为0.3mol ④M为OH-⑤SnCl62-是氧化产物 ⑥H+前面的配平系数为6.
| A、①③⑤⑥ | B、①②④⑤ |
| C、①②③④ | D、只有①③⑥ |
恒温下,将1mol N2和3mol H2在体积为2L的容器中混合,发生如下反应:N2(g)+3H2(g)?2NH3(g),2s时测得NH3的体积分数为25%.则下列说法中不正确的是( )
| A、用N2浓度的减少表示的平均反应速率为0.2 mol?L-1?s-1 |
| B、2 s时N2的转化率为40% |
| C、2 s时混合气体中n(N2)?n(H2)?n(NH3)=3:9:4 |
| D、2 s 时NH3的浓度为0.4 mol?L-1 |
某有机化合物的结构简式如图:
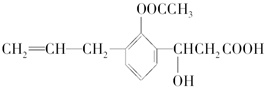
此有机化合物属于( )
①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥芳香化合物.

此有机化合物属于( )
①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥芳香化合物.
| A、①②③④⑥ | B、②④⑥ |
| C、②④⑤⑥ | D、①③⑤ |
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN═CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )
| A、CO为氧化产物,H2为还原产物 |
| B、CaCN2中含有非极性键 |
| C、HCN既是氧化剂又是还原剂 |
| D、每消耗10g CaCO3生成2.24L CO2 |