题目内容
设NA为阿佛加德罗常数,下列叙述正确的是( )
| A、通常状态下,O2与O3的混合物16克所含氧原子数为NA |
| B、将NO2和N2O4分子共NA个降温至标准状况下,其体积为22.4L |
| C、标况下,11.2LSO3所含的分子数目为0.5 NA |
| D、15.6gNa2O2跟过量CO2反应时,转移电子数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氧气和臭氧都是由氧原子构成,依据氧元素的质量计算氧原子的个数;
B.二氧化氮与四氧化二氮之间存在转化平衡:2NO2(g)?N2O4(g),该反应为放热反应,将NO2和N2O4分子共NA个降温至标况下,平衡向着正向移动;
C.SO3标况下不是气体;
D.过氧化钠与二氧化碳反应中过氧化钠既做氧化剂又做还原剂,质量换算物质的量,结合化学方程式计算电子转移数.
B.二氧化氮与四氧化二氮之间存在转化平衡:2NO2(g)?N2O4(g),该反应为放热反应,将NO2和N2O4分子共NA个降温至标况下,平衡向着正向移动;
C.SO3标况下不是气体;
D.过氧化钠与二氧化碳反应中过氧化钠既做氧化剂又做还原剂,质量换算物质的量,结合化学方程式计算电子转移数.
解答:
解:A.混合物中氧原的物质的量=
=1mol,所以含有氧原子的个数为NA,故A正确;
B.二氧化氮与四氧化二氮之间存在转化平衡:2NO2(g)?N2O4(g),该反应为放热反应,将NO2和N2O4分子共NA个降温至标况下,平衡向着正向移动,气体的总物质的量小于1mol,其体积小于22.4L,故B错误;
C.SO3标况下不是气体,不能使用气体摩尔体积,故C错误;
D.15.6g Na2O2 物质的量为0.2mol,Na2O2 与过量CO2反应时,过氧化钠是自身氧化还原反应,2Na2O2+2CO2=2Na2CO3+O2;每2mol过氧化钠反应电子转移2mol,所以0.2mol过氧化钠反应转移的电子数为0.2NA,故D正确;
故选:AD.
| 16g |
| 16g/mol |
B.二氧化氮与四氧化二氮之间存在转化平衡:2NO2(g)?N2O4(g),该反应为放热反应,将NO2和N2O4分子共NA个降温至标况下,平衡向着正向移动,气体的总物质的量小于1mol,其体积小于22.4L,故B错误;
C.SO3标况下不是气体,不能使用气体摩尔体积,故C错误;
D.15.6g Na2O2 物质的量为0.2mol,Na2O2 与过量CO2反应时,过氧化钠是自身氧化还原反应,2Na2O2+2CO2=2Na2CO3+O2;每2mol过氧化钠反应电子转移2mol,所以0.2mol过氧化钠反应转移的电子数为0.2NA,故D正确;
故选:AD.
点评:本题考查了阿伏伽德罗常数的应用,主要是质量换算物质的量计算微粒数,氧化还原反应的电子转移数的计算,气体摩尔体积的应用条件,过氧化钠的性质,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用来证明棉花和淀粉都是多糖的实验方法是( )
| A、放入氧气中燃烧,检验燃烧产物都是CO2和H2O |
| B、放入银氨溶液中微热,都不发生银镜反应 |
| C、加入浓硫酸后微热,都脱水而变黑 |
| D、分别放入稀酸后煮沸几分钟,用NaOH溶液中和反应后的溶液,再加入新制的Cu(OH)2悬浊液共热,都生成红色沉淀 |
下列化学用语表达正确的是( )
A、Cl-的结构示意图: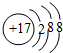 | ||
B、氯化氢分子的电子式: | ||
C、CH4Si的结构式: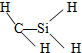 | ||
D、质量数为137的钡原子:
|
在海带中碘的提取和检验实验中,下列操作不正确的是( )
| A、灼烧灰化完成时,用坩埚钳把坩埚移至石棉网上 |
| B、用酒精萃取碘水中的碘 |
| C、用淀粉溶液检验碘的存在 |
| D、上层溶液从分液漏斗上口倒出 |
下列说法不正确的是( )
| A、除去N2中的少量O2:通过灼热的Cu粉,收集气体 |
| B、铅蓄电池在放电时,Pb作为负极,不断转化为PbSO4 |
| C、用盐酸酸化KMnO4溶液可以增强其氧化性 |
| D、强电解质在水中溶解度不一定大于弱电解质在水中的溶解度 |
用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A、2g H2含有的氢原子数目为NA |
| B、常温常压下,22.4L O2含有的分子数目为NA |
| C、1L 1mol?L-1 KOH溶液中含有的钾离子数目为NA |
| D、1mol Zn变为Zn2+时失去的电子数目为NA |
2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙、丁四个容器体积均为2L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
下列判断中,正确的是( )
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
| n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
| 含硫反应物的平衡转化率% | 80 | α1 | α2 | α3 | |
| A、乙中SO3的平衡转化率为α1=20% |
| B、平衡时,丙中c(SO3)是甲中的2倍 |
| C、平衡时,α3<α1 |
| D、该温度下,平衡常数的值为400 |
某有机化合物的结构简式如图 此有机化合物属于( )
此有机化合物属于( )
①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥酚类.
 此有机化合物属于( )
此有机化合物属于( )①烯烃 ②多官能团有机化合物 ③芳香烃 ④烃的衍生物 ⑤高分子化合物 ⑥酚类.
| A、①②③④ | B、②④ |
| C、②④⑤ | D、①③⑤⑥ |
铅笔是常用的学习用品,铅笔芯的主要成分是石墨和黏土.某型号的铅笔芯质量的一半成分是石墨,用该铅笔写一个化学方程式消耗的质量约1mg,那么铅笔芯中减少的碳原子数约为( )
| A、2.5×1019个 |
| B、2.5×1022个 |
| C、5×1019个 |
| D、5×1022个 |