题目内容
20.根据图所示的N2 (g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是( )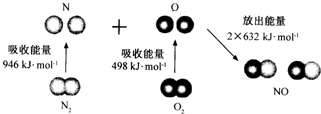
| A. | N2 (g)和O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 molO原子结合生成O2(g)时需要吸收498kJ能量 | |
| C. | N2(g)+O2(g)=2NO(g)的反应热△H=+1444kJ•mol-1 | |
| D. | 1molNO(g)分子中的化学键断裂时需要吸收632kJ能量 |
分析 A.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,焓变为负值是放热反应,焓变是正值是吸热反应;
B.原子结合形成分子的过程是放热过程;
C.结合A中的计算判断;
D.形成2molNO放热2×632kJ能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量.
解答 解:A.反应N2(g)+O2(g)=2NO(g)的焓变△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,该反应是吸热反应,故A错误;
B.原子结合形成分子的过程是化学键形成过程,是放热过程,2 molO原子结合生成O2(g)时需要放出498kJ能量,故B错误;
C.由A中计算可知N2(g)+O2(g)=2NO(g)的反应热△H=+180kJ/mol,故C错误;
D.形成2molNO放热2×632kJ能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量,故D正确,
故选:D.
点评 本题考查化学反应中能量变化、吸热反应与放热反应,根据能量守恒理解键能与焓变关系,题目难度不大.

练习册系列答案
相关题目
18.下列除去杂质的方法正确的是( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | NaHCO3固体 | Na2CO3固体 | / | 加热 |
| B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| C | FeCl2 溶液 | FeCl3溶液 | Cu | 过滤 |
| D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
8.下列各组离子中,在酸性溶液中能够大量共存,且通入Cl2后没有明显变化的是( )
| A. | K+、Na+、Cl-、I- | B. | Ca2+、Mg2+、HCO3-、NO3- | ||
| C. | K+、Cu2+、SO42-、Cl- | D. | Ag+、Ba2+、NO3-、CO32- |
12.高温条件下,某钾盐发生如下反应:4K2Cr2O7═4K2CrO4+2X+3O2↑,则生成物X的是( )
| A. | CrO2 | B. | CrO3 | C. | Cr2O3 | D. | Cr2O5 |
9.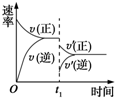 在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )
在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )
 在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )
在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )| A. | 催化剂失效 | B. | 减小生成物的浓度 | ||
| C. | 降低体系温度 | D. | 增大容器的体积 |
10.Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 金属性:Na>Mg>Al | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:Na>Mg>Al | D. | 碱性:NaOH<Mg(OH)2<Al(OH)3 |
 合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.
合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.