题目内容
12.若以NA代表阿伏加德罗常数,则下列说法正确的是( )| A. | 氯化氢的摩尔质量等于NA个氯化氢分子的质量 | |
| B. | 常温常压下1mol二氧化碳的体积大于22.4L | |
| C. | 64g金属铜发生氧化反应,一定失去2NA个电子 | |
| D. | 62g氧化钠溶于水后,所得溶液中含有NA个O2-离子 |
分析 A.摩尔质量和质量的单位不同;
B.常温常压下,温度高于标准状况,分子间距离增大1mol气体的体积大于标准状况下的气体摩尔体积;
C.铜反应后的化合价有-1、-2价;
D.Na2O溶于水后和水反应生成NaOH,故所得溶液中无O2-离子.
解答 A.氯化氢的摩尔质量为36.5g/mol,显然氯化氢的摩尔质量与NA个氯化氢分子的质量,单位不相同,故A错误;
B.常温常压下,温度高于标准状况,分子间距离增大1mol气体的体积大于标准状况下的气体摩尔体积,常温常压下,1mol CO2所占的体积大于22.4L,故B正确;
C.铜反应后生成的化合价有两种:-1、-2价,64g铜发生氧化还原反应,可能失去电子数是NA、2NA,故C错误;
D.Na2O溶于水后和水反应生成NaOH,故所得溶液中无O2-离子,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
3.I.有X、Y、Z、R四种短周期元素,Y、Z、R同周期.相关信息如下:
(1)Z元素在周期表的位置是第三周期第VIIA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为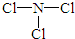 ;
;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为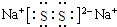 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
II.元素X与氢可形成多种化合物,如丙、丁、戊.
(1)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(2)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(3)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物ag与足量盐酸反应,测定生成气体标况的体积为VL,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水蒸气可形成一种常见的漂白性物质.则甲的结构式为
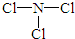 ;
;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
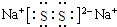 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .II.元素X与氢可形成多种化合物,如丙、丁、戊.
(1)丙与醋酸类似,为一元弱酸,对热十分稳定但受撞击就爆炸.8.6g丙爆炸分解生成H2和6.72L(标况下)X2.写出其爆炸的化学方程式2HN3=3N2+H2 ;
(2)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1,则物质丁的化学式为NH4H;
(3)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$N2+2Fe+3H2O,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物ag与足量盐酸反应,测定生成气体标况的体积为VL,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.
20. 已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
 已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )
已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol 该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为( )| A. | 5 mol | B. | 6 mol | C. | 7 mol | D. | 8 mol |
17.CH4分子中的4个H被苯基取代后的分子结构如图所示,则关于该有机物下列说法正确的是( )


| A. | 该有机物分子式为C25H24 | |
| B. | 该多环芳烃属于稠环芳烃 | |
| C. | 该分子中最多可能有13个碳原子在同一平面上 | |
| D. | 该有机物能使酸性高锰酸钾溶液褪色 |
4.下列说法不正确的是( )
| A. | 利用溴单质的氧化性可以把碘离子转化为碘单质 | |
| B. | 实验室常用NaOH溶液吸收多余的Cl2以避免污染 | |
| C. | Cl2不能使有色布条褪色,但Cl2具有氧化性 | |
| D. | 过量的红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl2 |
1.如表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:
(1)在这些元素中,(用元素符号填写,下同)最活泼的金属元素是Na;最活泼的非金属元素是F;最不活泼的元素是Ar.
(2)这些元素的最高价氧化物对应的水化物中酸性最强的是HClO4;能形成两性氢氧化物的元素是Al.
(3)元素的非金属性②大于⑥;氢化物的稳定性⑥小于⑦(填“大于”“小于”或“等于”)
(4)⑥的元素符号为S,原子结构示意图为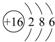
(5)④和⑦形成的化合物的电子式为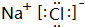 .
.
(6)写出④元素单质与水反应的离子方程式2Na+2H2O═2Na++2OH-+H2↑
(7)写出④的最高价氧化物对应的水化物与⑤的最高价氧化对应的水化物反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)这些元素的最高价氧化物对应的水化物中酸性最强的是HClO4;能形成两性氢氧化物的元素是Al.
(3)元素的非金属性②大于⑥;氢化物的稳定性⑥小于⑦(填“大于”“小于”或“等于”)
(4)⑥的元素符号为S,原子结构示意图为

(5)④和⑦形成的化合物的电子式为
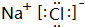 .
.(6)写出④元素单质与水反应的离子方程式2Na+2H2O═2Na++2OH-+H2↑
(7)写出④的最高价氧化物对应的水化物与⑤的最高价氧化对应的水化物反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O.
17.下列叙述正确的是( )
| A. | 固态Na2O2和熔融态NaHSO4中的阴、阳离子个数比均为1:1 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H8-2m+nR或RH8-2m+n | |
| D. | 元素周期表中L层电子为奇数的元素的化合价也都是奇数 |





 ,B含有的含氧官能团是酯基(写名称).
,B含有的含氧官能团是酯基(写名称). ,D为CH3CH2CH2CHO.
,D为CH3CH2CH2CHO. .
.