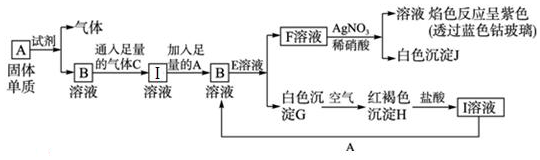
题目内容
6.在2H2S+SO2═3S↓+2H2O的反应中,当有8×6.02×1023个电子发生转移时,得到的氧化产物比还原产物多( )| A. | 64 g | B. | 32 g | C. | 1.5mol | D. | 3 mol |
分析 在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,H2S中S元素的化合价由-2升高到0,以此来解答.
解答 解:在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,为氧化剂;H2S中S元素的化合价由-2升高到0,为还原剂,则S单质既是氧化产物又是还原产物,当有8×6.02×1023个电子发生转移时,生成6molS,即氧化产物和还原产物的和为6mol,其中H2S被氧化生成的S为4mol,SO2被还原生成的S为2mol,则氧化产物比还原产物多2mol,即64g,
故选A.
点评 本题考查氧化还原反应,注意从氧化化合价的角度认识氧化还原反应的相关概念和相关物质的性质,答题时注意题给信息为解答该题的关键.

练习册系列答案
相关题目
1.欲配制1.00mol/L的NaCl溶液980mL,需要使用的仪器和药品是( )
| A. | 1 000 mL容量瓶,58.5 g NaCl | B. | 980 mL容量瓶,57.3 g NaCl | ||
| C. | 500 mL容量瓶,58.5 gNaCl | D. | 1 000 mL容量瓶,117.0 g NaC1 |
18.下列说法不正确的是( )
| A. | 淀粉和纤维素都可以在酸性条件下水解生成葡萄糖 | |
| B. | 煤的气化、液化和干馏都是煤综合利用的主要方法,都属于物理变化 | |
| C. | 地沟油发生皂化反应后加入饱和食盐水,搅拌发现液面上有固体物质 | |
| D. | 蛋白质溶液中加入浓的硫酸铵溶液,有固体析出 |
4.已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{c(C)×c(D)}{c(A)×c(B)}$,△H=>0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1.则A的平均反应速率v(A)=0.025mol/(L.s).该反应达到平衡时A的转化率为80%,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为不变(填”变大“、”变小“或”不变“)
(3)判断反应是否达到平衡的依据为c(填字母代号).
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50mol D,此时v正大于v逆(填”大于“、”小于“或”等于“).
| |温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
| 平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
(1)该反应的平衡常数表达式K=$\frac{c(C)×c(D)}{c(A)×c(B)}$,△H=>0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1.则A的平均反应速率v(A)=0.025mol/(L.s).该反应达到平衡时A的转化率为80%,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为不变(填”变大“、”变小“或”不变“)
(3)判断反应是否达到平衡的依据为c(填字母代号).
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时,若向另一相同容器中充入0.30molA、0.40mol B、0.40mol C和0.50mol D,此时v正大于v逆(填”大于“、”小于“或”等于“).
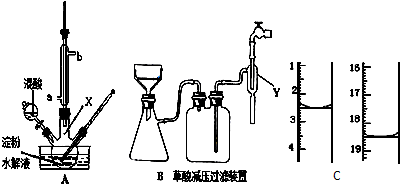
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
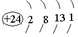 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.
与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.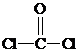 ,其中碳氧原子之间共价键是c(填序号)
,其中碳氧原子之间共价键是c(填序号)