题目内容
18.下列关于Ca(ClO)2溶液的叙述正确的是( )| A. | 溶液中只存在2种化合物的分子 | |
| B. | 通入CO2时溶液的漂白作用减弱 | |
| C. | 该溶液中A13+、Fe2+、SO42-、NO3-可以大量共存 | |
| D. | 与SO2反应的离子方程式为Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
分析 A.次氯酸钙溶于水完全电离得到钙离子和次氯酸根离子,次氯酸根离子是弱酸阴离子水解生成次氯酸;
B.碳酸酸性大于次氯酸,通入CO2时反应生成次氯酸;
C.A13+离子水解显酸性,硝酸根离子具有强氧化性能氧化亚铁离子;
D.次氯酸根离子具有强氧化性能优惠二氧化硫为硫酸.
解答 解:A.次氯酸钙是离子化合物,溶解在溶液中次氯酸根离子水解生成次氯酸,溶液中存在两种分子是溶剂水分子和次氯酸分子,故A正确;
B.碳酸酸性大于次氯酸,通入CO2时反应生成次氯酸,CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO,漂白作用增强,故B错误;
C.A13+离子水解显酸性,硝酸根离子具有强氧化性能氧化亚铁离子为铁离子,离子不能大量共存,故C错误;
D.次氯酸根离子具有强氧化性能优惠二氧化硫为硫酸,反应的离子方程式为:ClO-+SO2+H2O=SO42-+2H++Cl-,故D错误;
故选A.
点评 本题考查了物质性质、氧化还原反应、离子共存、弱酸制备原理等,在基础是解题关键,题目难度中等.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
8.某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2.按如下流程可制得Cu3N和铁红.
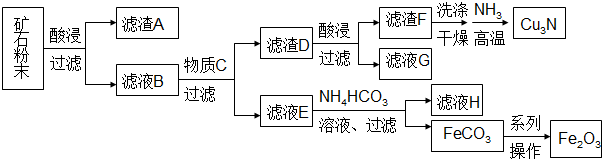
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 每生成1mol Cu3N,转移的电子为6mol | |
| B. | 滤液G可以并入滤液E加以利用 | |
| C. | 加入NH4HCO3溶液需控制温度以抑制Fe2+水解和NH4HCO3分解 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
6.X、Y、Z、W属于短周期主族元素.X元素的原子半径最大,Y元素的最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子核外电子数之比为2:1,下列说法中错误的是( )
| A. | X与Y形成的两种化合物中阴阳离子个数比为1:2 | |
| B. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 | |
| C. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物熔沸点低 | |
| D. | Z、W、R的最高价氧化物对应水化物的酸性强弱顺序是R>W>Z |
10.常温下,向20mL 0.1mol/LHA(一种弱酸)溶液中加入10mL 0.1mol/LNaOH溶液,充分反应后,有关溶液中微粒浓度关系不正确的是( )
| A. | 若溶液pH=7,则c(A-)=c(HA) | |
| B. | 若c(A-)>c(HA),则溶液中水电离的c(H+)<1.0×10-7mol/L | |
| C. | 若pH>7,加水稀释c(A-)/c(HA)增大 | |
| D. | 溶液中,c(A-)=2c(H+)+c(HA)-2c(OH-) |
7.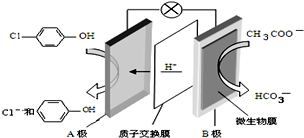 污水治理越来越引起人们重视,可以通过膜电池除去废水
污水治理越来越引起人们重视,可以通过膜电池除去废水 中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的( )
中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的( )
 污水治理越来越引起人们重视,可以通过膜电池除去废水
污水治理越来越引起人们重视,可以通过膜电池除去废水 中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的( )
中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的( )| A. | A为电池的正极,发生还原反应 | |
| B. | 电流方向从B极沿导线经小灯泡流向A极 | |
| C. | A极的电极反应式为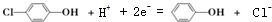 | |
| D. | 当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA |
8.某溶液中只含有四种离子NH4+、Cl-、OH-、H+,已知该溶液中溶质可能为一种或两种,则该溶液中四种离子浓度大小关系可能为( )
| A. | [NH4+]>[Cl-]>[OH-]>[H+] | B. | [NH4+]=[Cl-]>[H+]=[OH-] | C. | [Cl-]>[NH4+]>[OH-]>[H+] | D. | [OH-]>[NH4+]>[H+]>[Cl-] |
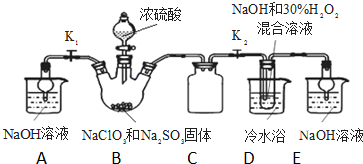 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题: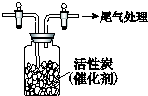 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.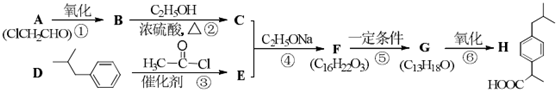
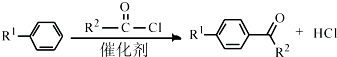 (R1、R2代表烷基)
(R1、R2代表烷基)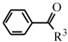 +ClCH2COOR4+R4ONa→
+ClCH2COOR4+R4ONa→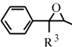 COOR4+R4OH+NaCl(R3、R4代表烷基)
COOR4+R4OH+NaCl(R3、R4代表烷基)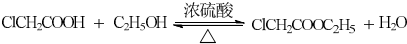 .
. .
.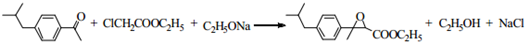 .
.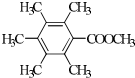 、
、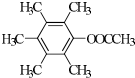 、
、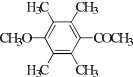 .
.