题目内容
 (1)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
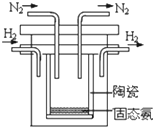
(1)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨.其实验装置如图.阴极的电极反应式
(2)N2H4是一种高效清洁的火箭燃料.NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为
(3)8g N2H4(g)燃烧生成氮气和水蒸汽时,放出133.5kJ热量,写出该反应的热化学方程式
考点:电解原理,热化学方程式
专题:基本概念与基本理论
分析:(1)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气;
(2)NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,故还生成氯化钠与水;
(3)根据热化学方程式的书写原则和注意问题写出;注意物质的聚集状态标注,焓变的正负号和单位.
(2)NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,故还生成氯化钠与水;
(3)根据热化学方程式的书写原则和注意问题写出;注意物质的聚集状态标注,焓变的正负号和单位.
解答:
解:(1)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3,故答案为:N2+6H++6e-=2NH3;
(2)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(3)8g N2H4(g)为0.25mol,已知0.25mol液态肼和足量双氧水反应生成氮气和水蒸气时放出133.5KJ的热量;肼和双氧水反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-534KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-534KJ/mol.
(2)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(3)8g N2H4(g)为0.25mol,已知0.25mol液态肼和足量双氧水反应生成氮气和水蒸气时放出133.5KJ的热量;肼和双氧水反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-534KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-534KJ/mol.
点评:本题考查了电极反应式书写、化学方程式书写、热化学方程式书写,题目难度中等.

练习册系列答案
相关题目
量取10mL碘的饱和水溶液,倒入分液漏斗中,然后注入4mL四氯化碳,用力振荡后静置,实验现象为( )
| A、液体分层,上层为四氯化碳层,黄色 |
| B、液体分层,上层为水层,紫色 |
| C、液体分层,下层为四氯化碳层,紫色 |
| D、液体分层,下层为水层,黄色 |
下列物质的贮存方法,错误的是( )
| A、钠存入在煤油里 |
| B、硝酸存放在无色试剂瓶中 |
| C、生产上用铝槽车装浓硝酸 |
| D、烧碱溶液存放在橡皮塞的试剂瓶中 |
下列有关实验操作和说法正确的是( )
| A、用pH试纸检验气体的酸碱性时,一定要先用蒸馏水润湿 |
| B、润洗滴定管:从滴定管上口加入所要盛装的酸或碱溶液至“0”刻线,再将液体从滴定管下部放出,重复操作2~3次 |
| C、用瓷坩埚加热熔化碳酸钠固体 |
| D、Mg和Al分别为电极,插入NaOH溶液中,构成原电池,探究Mg、Al的活泼性 |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )
A、 若反应为2A(g)+B(g)?2C(g),则△H>0,P2>P1 |
B、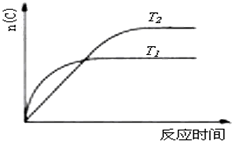 若反应为2A(g)?C(g),则△H>0,T1>T2 |
C、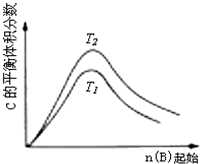 反应为3A(g)+B(g)?2C(g),则△H>0,T2>T1;或△H<0,T2<T1 |
D、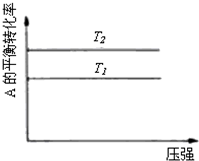 反应为A(g)+B(g)?2C(g),则△H<0,T2>T1 |
将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是( )
| A、C12 |
| B、NH3 |
| C、CO2 |
| D、NO2 |