题目内容
(1)配平以下化学方程式:
Cu+ HNO3- Cu(NO3)2+ NO+ H2O
KMnO4+ HCl- MnCl2+ Cl2+ KCl+ H2O
Fe2++ H2O2+ H+- Fe2++ H2O
(2)有一瓶无色澄清的溶液,其可能含NH4+、H+、Na+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、Cl-、I-,取该溶液进行如下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
(3)取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
(4)取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
根据上述实验事实确定并回答:
在溶液中肯定存在的上述离子有 ,肯定不存在的上述离子有 ,还不能确定是否存在的上述离子有 .
(2)有一瓶无色澄清的溶液,其可能含NH4+、H+、Na+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、Cl-、I-,取该溶液进行如下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
(3)取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
(4)取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
根据上述实验事实确定并回答:
在溶液中肯定存在的上述离子有
考点:氧化还原反应方程式的配平,常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题,氧化还原反应专题
分析:(1)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据氧化还原反应中得失电子数相等进行配平.
(2)根据实验(1)判断不存在的离子是与强酸反应的CO32-离子;
根据实验(2)碘在四氯化碳中呈紫色,通过实验现象判断;
根据实验(3)镁离子、铝离子、铁离子都和氢氧化钠反应生成沉淀,由此判断不存在的离子;
根据实验(4)钡离子和碳酸钠反应生成白色沉淀,通过实验现象判断,溶液中有与Na2CO3溶液反应生成白色沉淀的Ba2+;
根据实验(5)铵根离子的特征反应判断.
(2)根据实验(1)判断不存在的离子是与强酸反应的CO32-离子;
根据实验(2)碘在四氯化碳中呈紫色,通过实验现象判断;
根据实验(3)镁离子、铝离子、铁离子都和氢氧化钠反应生成沉淀,由此判断不存在的离子;
根据实验(4)钡离子和碳酸钠反应生成白色沉淀,通过实验现象判断,溶液中有与Na2CO3溶液反应生成白色沉淀的Ba2+;
根据实验(5)铵根离子的特征反应判断.
解答:
解:(1)该反应中元素的化合价变化如下:Cu→Cu(NO3)2,Cu元素的化合价由0价→+2价,一个Cu失去2个电子;
HNO3→NO,N元素的化合价由+5价→+2价,一个HNO3得到3个电子,所以得失电子的最小公倍数为6,所以Cu的计量数为3,Cu(NO3)2的计量数为3,NO的计量数为2,由于硝酸部分被还原,根据原子守恒,HNO3的计量数为8,H2O计量数为4,
故答案为:3;8;3;2;4;
反应中HCl→Cl2,氯元素化合价由-1价升高为0价,共升高2价,KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为10,故KMnO4系数为2,故Cl2系数为5,根据Mn元素守恒可知MnCl2系数为2,根据K元素守恒可知KCl系数为2,根据Cl元素守恒可知HCl系数为16,根据H元素可知H2O的系数为8,配平后方程式为:
故答案为:2、16、2、2、5、8;
铁元素的价态升高了一价,双氧水中氧元素的化合价共降低了两价,所以铁元素前面是系数2,双氧水前面系数是1,根据电荷守恒和原子守恒,可以知道水前面系数是2,
故答案为:2、1、2、2、2;
(2)(1)溶液呈强酸性,所以溶液中不存在与强酸反应的CO32-离子;
(2)碘离子能和氯水反应生成碘单质,碘在四氯化碳中呈紫色,通过实验现象判断,溶液中含有I-;
(3)镁离子、铝离子、铁离子都和氢氧化钠反应生成沉淀,通过实验现象判断,溶液中不存在与氢氧根离子反应生成沉淀的Mg2+、Al3+、Fe3+;
(4)钡离子和碳酸钠反应生成白色沉淀,通过实验现象判断,溶液中有与Na2CO3溶液反应生成白色沉淀的Ba2+,如果有Ba2+离子,溶液中就没有SO42-;
(5)铵根离子在加热条件下与氢氧化钠反应生成能使湿润的红色石蕊试纸变蓝色的氨气,这是铵根离子的特征反应;
通过实验现象判断,溶液中有NH4+,
通过以上现象不能判断溶液中是否含有K+、Na+、Cl-;
故答案为:I-、NH4+、Ba2+;SO42-、CO32-、Mg2+、Al3+、Fe3+;K+、Na+、Cl-.
HNO3→NO,N元素的化合价由+5价→+2价,一个HNO3得到3个电子,所以得失电子的最小公倍数为6,所以Cu的计量数为3,Cu(NO3)2的计量数为3,NO的计量数为2,由于硝酸部分被还原,根据原子守恒,HNO3的计量数为8,H2O计量数为4,
故答案为:3;8;3;2;4;
反应中HCl→Cl2,氯元素化合价由-1价升高为0价,共升高2价,KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为10,故KMnO4系数为2,故Cl2系数为5,根据Mn元素守恒可知MnCl2系数为2,根据K元素守恒可知KCl系数为2,根据Cl元素守恒可知HCl系数为16,根据H元素可知H2O的系数为8,配平后方程式为:
故答案为:2、16、2、2、5、8;
铁元素的价态升高了一价,双氧水中氧元素的化合价共降低了两价,所以铁元素前面是系数2,双氧水前面系数是1,根据电荷守恒和原子守恒,可以知道水前面系数是2,
故答案为:2、1、2、2、2;
(2)(1)溶液呈强酸性,所以溶液中不存在与强酸反应的CO32-离子;
(2)碘离子能和氯水反应生成碘单质,碘在四氯化碳中呈紫色,通过实验现象判断,溶液中含有I-;
(3)镁离子、铝离子、铁离子都和氢氧化钠反应生成沉淀,通过实验现象判断,溶液中不存在与氢氧根离子反应生成沉淀的Mg2+、Al3+、Fe3+;
(4)钡离子和碳酸钠反应生成白色沉淀,通过实验现象判断,溶液中有与Na2CO3溶液反应生成白色沉淀的Ba2+,如果有Ba2+离子,溶液中就没有SO42-;
(5)铵根离子在加热条件下与氢氧化钠反应生成能使湿润的红色石蕊试纸变蓝色的氨气,这是铵根离子的特征反应;
通过实验现象判断,溶液中有NH4+,
通过以上现象不能判断溶液中是否含有K+、Na+、Cl-;
故答案为:I-、NH4+、Ba2+;SO42-、CO32-、Mg2+、Al3+、Fe3+;K+、Na+、Cl-.
点评:本题考查了氧化还原反应方程式的配平,常见离子的检验,考查物质的检验有:常见阳离子的检验、常见阴离子的检验、常见气体的检验;要注意的是:根据氧化还原反应中得失电子数相等配平即可,注意还原剂部分被氧化和氧化剂部分被还原,焰色反应是元素的性质不是单质的性质,要观察钾元素的焰色反应时,必须透过蓝色钴玻璃,除去钠元素的干扰,才能观察到钾元素焰色反应的颜色.

练习册系列答案
相关题目
乙醇催化氧化为乙醛过程中化学键的断裂与形成情况可表示如下:下列醇能被氧化为醛类化合物的是( )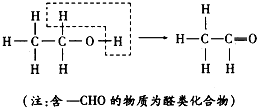

| A、(CH3)3COH |
B、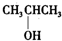 |
C、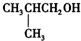 |
| D、CH3CH2CH(CH3)OH. |
下列有关分散系的叙述正确的是( )
| A、Al(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
| B、悬浊液中一定不含直径小于10-9m的微粒 |
| C、胶体区别于其他分散系的本质特征是胶体可发生丁达尔效应 |
| D、食盐溶液静置后会分层,下层比上层咸 |
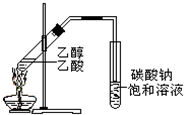 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:

 乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.