题目内容
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一.
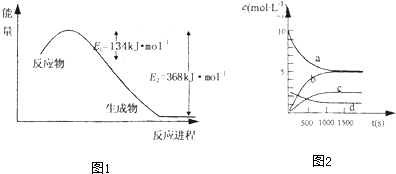
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一.(1)如图1,是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g)+O2 (g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为
③如图2,表示N2O5 的浓度的变化曲线是
(3)下列各项能作为判断N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的依据的是
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变.
考点:化学平衡的计算,热化学方程式,化学平衡状态的判断
专题:
分析:(1)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;
(2)①根据平衡常数表达式的书写来解答;根据升高温度平衡常数减小,说明升高温度平衡向逆反应方向移动,再根据温度对化学平衡的影响;
②根据表格可知1000S时反应达到平衡,根据转化率的公式求解;根据再通入一定量氮气,没有引起体系中4NO2(g)+O2 (g)?2N2O5(g)各物质浓度的变化;
③根据反应物的浓度在减少,生成物的浓度再增加,以及利用系数之比等于化学反应速率之比来求解;根据化学反应速率V=
,利用表格数据来求NO2的速率,然后利用系数之比等于化学反应速率之比来求O2的速率;
(3)根据平衡状态的判断依据判断.
(2)①根据平衡常数表达式的书写来解答;根据升高温度平衡常数减小,说明升高温度平衡向逆反应方向移动,再根据温度对化学平衡的影响;
②根据表格可知1000S时反应达到平衡,根据转化率的公式求解;根据再通入一定量氮气,没有引起体系中4NO2(g)+O2 (g)?2N2O5(g)各物质浓度的变化;
③根据反应物的浓度在减少,生成物的浓度再增加,以及利用系数之比等于化学反应速率之比来求解;根据化学反应速率V=
| △c |
| △t |
(3)根据平衡状态的判断依据判断.
解答:
解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234kJ?mol-1;
故答案为:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234kJ?mol-1;
(2)①化学平衡常数等于生成物的浓度系数次方之积除以反应物的浓度系数次方之积,所以K=
;升高温度平衡常数减小,说明升高温度平衡向逆反应方向移动,而升高温度平衡向吸热的方向移动,所以逆反应吸热,则正反应放热,故答案为:
;放;
②根据表格可知1000S时反应达到平衡,已反应的NO2为:20mol-10.08mol=9.92mol,NO2的转化率为
×100%=49.6%;再通入一定量氮气,没有引起体系中4NO2(g)+O2 (g)?2N2O5(g)各物质浓度的变化,所以平衡不移动,转化率不变,故答案为:49.6%;不变;
③因反应物的浓度在减少,生成物的浓度再增加,根据方程式可知O2是NO2的反应速率的
,N2O5和NO2的反应速率的
,则a为NO2的变化曲线;c为N2O5的变化曲线,d为氧气的变化曲线,0~500s内反应的平均速率v(NO2)=
=6.04×10-3mol/(L?s),v(O2)=v(NO2)×
=1.51×10-3mol/(L?s),
故答案为:c;1.51×10-3mol/(L?s);
(3)A、容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故A错误;
B、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,故B错误.
C、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故C正确;
D、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故D错误.
故答案为:C.
故答案为:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234kJ?mol-1;
(2)①化学平衡常数等于生成物的浓度系数次方之积除以反应物的浓度系数次方之积,所以K=
| c2(N 2O5) |
| c4(NO 2)c(O2) |
| c2(N 2O5) |
| c4(NO 2)c(O2) |
②根据表格可知1000S时反应达到平衡,已反应的NO2为:20mol-10.08mol=9.92mol,NO2的转化率为
| 9.92mol |
| 20mol |
③因反应物的浓度在减少,生成物的浓度再增加,根据方程式可知O2是NO2的反应速率的
| 1 |
| 4 |
| 1 |
| 2 |
| ||
| 500S |
| 1 |
| 4 |
故答案为:c;1.51×10-3mol/(L?s);
(3)A、容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故A错误;
B、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,故B错误.
C、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故C正确;
D、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故D错误.
故答案为:C.
点评:本题考查了热化学方程式、化学平衡常数、化学平衡移动、化学反应速率的计算等,题目较为综合,难度中等,注意做题方法、判断规律的积累.

练习册系列答案
相关题目
下列说法正确的是( )
| A、两种难溶电解质,其中Ksp小的溶解度一定小 |
| B、溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 |
| C、所谓沉淀完全就是用沉淀剂将溶液中的某一离子除净 |
| D、相同温度下,AgCl固体在0.01 mol?L-1 KI溶液中的溶解的质量比在0.01mol?L-1 KNO3溶液中大,但Ksp不变 |
下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的气体(暂不考虑尾气吸收).关于这些装置的接,下列说法正确的是( )
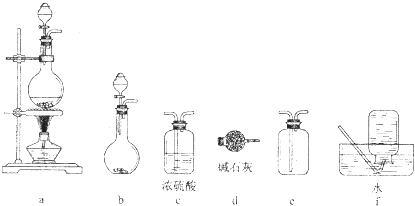

| A、制备收集C2H4:连接a→d→f |
| B、制备收集NO2:连接a→c→f |
| C、制备收集Cl2:连接a→d→e |
| D、制备收集NH3:连接b→→e |
下列有关叙述正确的是( )
| A、治理“地沟油”,可通过水解反应制得肥皂 |
| B、向海水中加净水剂明矾可以使海水淡化 |
| C、明胶是营养型食品增稠剂,可从皮革制品的下脚料及旧皮鞋中提取 |
| D、绿色化学的核心是对环境污染进行治理 |

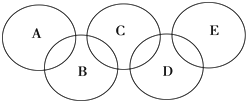 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素, ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2,根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2,根据以上信息回答下列问题:


