题目内容
1.92g电解铜片(纯铜)置于10mL14.2mol?L-1的浓硝酸中,铜片不断溶解,直至完全消失,反应中共收集到气体1.12L(标准状况).假定反应前后溶液体积不变,且不考虑N2O4的存在.试求:
(1)反应后的溶液中硝酸铜的物质的量.
(2)反应后的溶液中硝酸的物质的量.
(3)反应产生的气体与一定量的氧气混合后,恰好能被足量的水完全吸收转化为硝酸,则所需氧气在标准状况下的体积为多少升?
(1)反应后的溶液中硝酸铜的物质的量.
(2)反应后的溶液中硝酸的物质的量.
(3)反应产生的气体与一定量的氧气混合后,恰好能被足量的水完全吸收转化为硝酸,则所需氧气在标准状况下的体积为多少升?
考点:氧化还原反应的计算
专题:
分析:n(Cu)=
=0.03mol,n(HNO3)=14.2mol/L×0.01L=0.142mol,n(NOx)=
=0.05mol,
(1)根据Cu原子守恒计算生成硝酸铜的物质的量;
(2)根据N原子守恒知,反应后硝酸的物质的量=0.142mol-2n[Cu(NO3)2]-n(NOx);
(3)反应产生的气体与一定量的氧气混合后,恰好能被足量的水完全吸收转化为硝酸,Cu失去电子数等于硝酸得到的电子数,生成的氮氧化物和水、氧气反应时,氮氧化物失去的电子数等于氧气得到的电子数,所以Cu失去的电子数等于氧气得到的电子数,据此计算氧气体积.
| 1.92g |
| 64g/mol |
| 1.12L |
| 22.4L/mol |
(1)根据Cu原子守恒计算生成硝酸铜的物质的量;
(2)根据N原子守恒知,反应后硝酸的物质的量=0.142mol-2n[Cu(NO3)2]-n(NOx);
(3)反应产生的气体与一定量的氧气混合后,恰好能被足量的水完全吸收转化为硝酸,Cu失去电子数等于硝酸得到的电子数,生成的氮氧化物和水、氧气反应时,氮氧化物失去的电子数等于氧气得到的电子数,所以Cu失去的电子数等于氧气得到的电子数,据此计算氧气体积.
解答:
解:n(Cu)=
=0.03mol,n(HNO3)=14.2mol/L×0.01L=0.142mol,n(NOx)=
=0.05mol,
(1)Cu完全反应生成硝酸铜,根据Cu原子守恒得n[Cu(NO3)2]=n(Cu)=0.03mol,
答:反应后溶液中硝酸铜的物质的量是0.03mol;
(2)根据N原子守恒知,反应后硝酸的物质的量=0.142mol-2n[Cu(NO3)2]-n(NOx)=0.142mol-0.03mol×2-0.03mol=0.032mol,
答:反应后剩余硝酸的物质的量是0.032mol;
(3)反应产生的气体与一定量的氧气混合后,恰好能被足量的水完全吸收转化为硝酸,Cu失去电子数等于硝酸得到的电子数,生成的氮氧化物和水、氧气反应时,氮氧化物失去的电子数等于氧气得到的电子数,所以Cu失去的电子数等于氧气得到的电子数,则消耗氧气体积=
×22.4L/mol=0.336L,
答:需要氧气体积在标况下是0.336L.
| 1.92g |
| 64g/mol |
| 1.12L |
| 22.4L/mol |
(1)Cu完全反应生成硝酸铜,根据Cu原子守恒得n[Cu(NO3)2]=n(Cu)=0.03mol,
答:反应后溶液中硝酸铜的物质的量是0.03mol;
(2)根据N原子守恒知,反应后硝酸的物质的量=0.142mol-2n[Cu(NO3)2]-n(NOx)=0.142mol-0.03mol×2-0.03mol=0.032mol,
答:反应后剩余硝酸的物质的量是0.032mol;
(3)反应产生的气体与一定量的氧气混合后,恰好能被足量的水完全吸收转化为硝酸,Cu失去电子数等于硝酸得到的电子数,生成的氮氧化物和水、氧气反应时,氮氧化物失去的电子数等于氧气得到的电子数,所以Cu失去的电子数等于氧气得到的电子数,则消耗氧气体积=
| 0.03mol×2 |
| 4 |
答:需要氧气体积在标况下是0.336L.
点评:本题考查氧化还原反应的计算,侧重考查分析计算能力,灵活运用原子守恒、转移电子守恒即可解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应不属于消去反应的是( )
A、CH3CH2OH
| |||
B、CH3CHBrCH3+NaOH
| |||
C、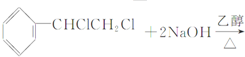  | |||
D、2CH3OH
|
在一定温度下,将CO和H2O(g)各1mol放在密闭容器中反应,到达平衡后测得CO2为0.6mol,再通入4mol H2O(g),到达新的平衡后,CO2的物质的量( )
| A、等于0.6mol |
| B、等于1mol |
| C、0.6mol<n(CO2)<1mol |
| D、大于1mol |
下列电池工作时,O2在正极放电的是( )
A、 锌锰电池 |
B、 氢燃料电池 |
C、 铅蓄电池 |
D、 镍镉电池 |
分别处于第二、三周期的主族元素A和B,它们离子的电子层相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B原子核外的电子总数分别为( )
| A、m+2、10+n |
| B、m、n |
| C、3、7 |
| D、m-2、10-n |
下列关于胶体的叙述中不正确的是( )
| A、布朗运动是胶体微粒特有的运动方式,只用肉眼就可以把胶体和溶液、浊液区别开来 |
| B、向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 |
| C、可利用丁达尔效应区分胶体与溶液 |
| D、胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现 |
一定质量的某有机物和足量钠反应,可得VaL气体,等质量的该有机物如果与足量小苏打反应,同温同压得到VbL气体,若Va=Vb,则该有机物可能是( )
| A、HOCH2COOH |
| B、HO-CH2CH2-CHO |
| C、HOOC-COOH |
| D、CH3COOH |
