题目内容
9.化学与生产、生活、社会密切相关.下列说法中不正确的是( )| A. | 雪白、漂亮的“白木耳”,可能是在用硫黄熏制的过程中产生的SO2所致 | |
| B. | 钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| C. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| D. | 硅胶可用作食品干燥剂和催化剂载体 |
分析 A.二氧化硫具有漂白性,雪白、漂亮的“白木耳”,可能是在用硫黄熏制的过程中产生的SO2所致;
B.钢铁在潮湿的空气中易生锈,是因为空气中有氧气和水蒸气,易发生电化学腐蚀而生锈;
C.从源头上消除工业生产对环境的污染是绿色化学的核心;
D.根据硅胶的结构、性质判断.
解答 解:A.二氧化硫有漂白性,“雪白、漂亮的“白木耳”,在用硫黄熏制的过程中产生的SO2使其漂白,故A正确;
B.钢铁为铁的合金,在潮湿的空气中形成原电池,发生电化学腐蚀,电化腐蚀分为吸氧腐蚀和析氢腐蚀,而析氢腐蚀只在较强酸性条件下才发生;所以钢铁在潮湿的空气中发生电化学腐蚀中的吸氧腐蚀而生锈,故B错误;
C.从源头上消除工业生产对环境的污染是绿色化学的核心,故C正确;
D.硅胶多孔,吸附能力很强,所以硅胶用作干燥剂、吸附剂,也可用作催化剂载体,故D正确;
故选B.
点评 本题考查了化学知识在生产、生活中的应用,属于基础知识的考查,题目难度不大,注意对基础知识的积累.

练习册系列答案
相关题目
19.铁及其化合物是中学化学中的一类重要物质.下列关于铁元素的叙述中正确的是( )
| A. | 5.6 g铁与足量的氯气反应失去的电子为0.2 mol | |
| B. | 25℃、pH=0的溶液中,Al3+、NH4+、NO3-、Fe2+可以大量共存 | |
| C. | 2Fe3++Fe═3Fe2+成立说明氧化性:Fe3+>Fe2+ | |
| D. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O |
20.在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-?[CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是( )
| A. | 蒸发浓缩 | B. | 加CuCl2固体 | C. | 加入AgNO3 | D. | 加入食盐晶体 |
17.目前我们生活中的食盐中往往要加“碘”,该成分主要是( )
| A. | KI | B. | I2 | C. | I- | D. | KIO3 |
4.下列离子方程式改写为化学方程式,正确的是( )
| A. | Ag++Cl-═AgCl↓,AgNO3+NaCl═AgCl↓+NaNO3 | |
| B. | Cu+2Ag+═Cu2++2Ag,Cu+2AgCl═CuCl2+2Ag | |
| C. | Ba2++SO${\;}_{4}^{2-}$═BaSO4↓,Ba(OH)2+H2SO4═BaSO4+2H2O | |
| D. | CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O,NaHCO+HCl═NaCl+CO2↑+H2O |
14.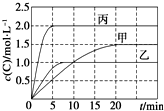 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
1.在溶液中能大量共存,加入OH-有沉淀析出,加入H+能放出气体的是( )
| A. | Na+、HCO3-、Ca2+、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | H+、Fe3+、NH4+、SO42- | D. | Mg2+、Na+、Cl-、CO32- |
18.相对分子质量为106.5的一氯代烃,有几种同分异构体( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
19.如表所示是某些物质的燃烧热数据:
①煤油的组成可看作C12H26,煤油燃烧生成液态水时的热化学方程式为2C12H26(l)+37O2(g)═24CO2(g)+26H2O(l)△H=-17142.8kJ•mol-1.
②由上表中的数据能(填“能”或“不能”)计算出反应:C2H4(g)+H2(g)→C2H6(g)的反应热.若能,该反应△H=-137.0kJ•mol-1(若不能,此空不填);若不能,原因是不填(若能,此空不填).
| 物质 | C(s) | H2(g) | C2H4(g) | C2H6(g) | C3H8(g) | C12H26(l) |
| △H/ kJ•mol-1 | -393.5 | -285.8 | -1 411.0 | -1 559.8 | -2 219.9 | -8 571.4 |
②由上表中的数据能(填“能”或“不能”)计算出反应:C2H4(g)+H2(g)→C2H6(g)的反应热.若能,该反应△H=-137.0kJ•mol-1(若不能,此空不填);若不能,原因是不填(若能,此空不填).