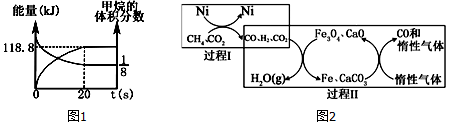
题目内容
9. 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O=1.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NH•H2O=1.6×10-4).利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定二甲胺溶液的曲线 | |
| B. | a点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+)]<c[(CH3)2NH•H2O] | |
| C. | d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| D. | b、c、e三点的溶液中,水的电离程度最大的是b点 |
分析 (CH3)2NH•H2O)为弱电解质,在溶液中部分电离,等浓度时离子浓度比NaOH小,则导电性较弱,由此可知②为(CH3)2NH•H2O的变化曲线,①为NaOH的变化曲线,加入HCl,(CH3)2NH•H2O溶液中离子浓度逐渐增大,导电性逐渐增强,NaOH与盐酸发生中和反应,离子浓度减小,由图象可知加入HCl10mL时完全反应,以此解答该题.
解答 解:A.由分析可知,曲线②为(CH3)2NH•H2O的变化曲线,故A错误;
B.①为NaOH的变化曲线,a点溶液中,溶质为等量的NaCl和HCl,②为(CH3)2NH•H2O的变化曲线,d点溶液中,溶质为(CH3)2NH2Cl,则a点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+)]>c[(CH3)2NH•H2O],故B错误;
C.d点溶液中,存在质子守恒,即:c(H+)=c(OH-)+c[(CH3)2NH•H2O],故C正确;
D.b点溶液中溶质为(CH3)2NH2Cl和(CH3)2NH•H2O,(CH3)2NH•H2O电离出氢氧根离子抑制水的电离,c点溶质为NaCl对水的电离无影响,e点的溶液中溶质为(CH3)2NH2Cl和HCl,HCl抑制水的电离,所以c点水的电离程度最大,故D错误.
故选C.
点评 本题以电导率为载体考查离子浓度大小比较、盐类水解等知识点,题目难度中等,明确混合溶液中溶质及其性质、溶液导电性强弱影响因素是解本题关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
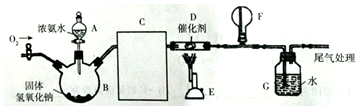
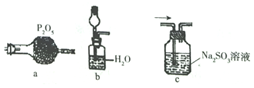
14.化学是建立在实验基础上的学科.关于下列各实验装置的叙述中,不正确的是( )

| A. | 装置①可用于实验室制取少量 NH3或 O2 | |
| B. | 可用从 a 处加水的方法检验装置②的气密性 | |
| C. | 实验室可用装置③收集 H2、NH3 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中 b 为阳离子交换膜、c 为阴离子交换膜 |
20.乙醇中的化学键如图,则下列说法中正确的是( )


| A. | 当乙醇发生催化氧化时,被破坏的键是②③ | |
| B. | 当乙醇与Na反应时,被破坏的键是① | |
| C. | 当乙醇与乙酸反应时,被破坏的键是② | |
| D. | 当乙醇发生催化氧化时,被破坏的键是①④ |
17.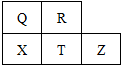 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断不正确的是( )| A. | 五种元素中Z的活动性最弱,T 的最高价氧化物对应水化合物酸性最强 | |
| B. | 氢化物的稳定性:R>Q>X;R>T>X | |
| C. | Q单质能从溶液中置换出X单质,R单质能从溶液中置换出Q单质 | |
| D. | X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
4.有X、Y、Z三种原子序数逐渐增大的主族元素,它们分别处于不同短周期,其中Y是自然界中形成化合物种类最多的元素,Z元素在地壳中的含量是同周期主族元素中最高的.则下列说法错误的是( )
| A. | X与其它元素之间只能形成共价键 | |
| B. | Z元素的最高价氧化物是玻璃的主要成分,其常温下就能与强碱发生反应 | |
| C. | 非金属性Y强于Z | |
| D. | 三种元素中X的原子半径最小 |
1. X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为16;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系.其中R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为16;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系.其中R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
 X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为16;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系.其中R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为16;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系.其中R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )| A. | X元素位于周期表中第16列 | |
| B. | X、Y、Z元素两两之间均能形成原子个数比为l:2的化合物 | |
| C. | X、Y、Z元素形成的化合物溶于水中,对水的电离平衡一定起抑制作用 | |
| D. | R和M的化学键类型和晶体类型都相同. |
7.下列说法正确的是( )
| A. | 金属与非金属分界线附近的元素既有金属性,又有非金属性,称为过渡元素 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 118号元素是由自然界中元素衰变得到的 | |
| D. | 同种元素的不同核素之间互称同位素 |