题目内容
8.实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl $\frac{\underline{\;加热\;}}{\;}$NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )| A. | NaNO2是氧化剂,NH4Cl是还原剂 | |
| B. | N2既是氧化产物,又是还原产物 | |
| C. | 氧化剂和还原剂的物质的量之比是1:1 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
分析 反应NaNO2+NH4Cl $\frac{\underline{\;加热\;}}{\;}$NaCl+N2↑+2H2O中N元素化合价由+3价、-3价变为0价,所以亚硝酸钠是氧化剂、氯化铵是还原剂,结合氮气和转移电子之间的关系式解答.
解答 解:A.该反应中N元素化合价由+3价、-3价变为0价,所以NaNO2是氧化剂,NH4Cl是还原剂,故A正确;
B.NaNO2是氧化剂,NH4Cl是还原剂,所以N2既是氧化产物,又是还原产物,故B正确;
C.NaNO2是氧化剂,NH4Cl是还原剂,二者的物质的量之比为1:1,故C正确;
D.该反应每生成1 mol N2时,转移电子的物质的量=1mol×(3-0)=3 mol,故D错误;
故选D.
点评 本题考查氧化还原反应,侧重考查基本概念、基本计算,题目难度中等,明确元素化合价变化是解本题关键,注意掌握氧化剂、还原性的判断方法.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案
相关题目
16.能表示人体大量喝水时,胃液的pH变化的是( )
| A. |  | B. |  | C. |  | D. |  |
3.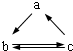 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( ) | a | b | c |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | Na2O2 | Na2CO3 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
20.聚四氟乙烯的耐热性和化学稳定性超过其他塑料,被称为“塑料王”.其合成路线如下:
三氯甲烷$\stackrel{HF、SbCl_{3}}{→}$二氟一氯甲烷$\stackrel{△}{→}$四氟乙烯$\stackrel{引发剂}{→}$聚四氟乙烯
下列说法中,不正确的是( )
三氯甲烷$\stackrel{HF、SbCl_{3}}{→}$二氟一氯甲烷$\stackrel{△}{→}$四氟乙烯$\stackrel{引发剂}{→}$聚四氟乙烯
下列说法中,不正确的是( )
| A. | “塑料王”聚四氟乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 三氯甲烷(CHCl3)可以用甲烷与氯气的取代反应来制取 | |
| C. | 四氟乙烯 (CF2=CF2)中所有的原子都在同一个平面上 | |
| D. | 四氟乙烯 (CF2=CF2)通过加聚反应生成“塑料王”聚四氟乙烯 |
17.实现下列变化,需要加入氧化剂的是( )
| A. | NH3→NO | B. | HCl→H2 | C. | NaCl→AgCl | D. | Fe3+→Fe2+ |