题目内容
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,5.6 L四氯化碳含有的分子数为0.25NA |
| B、标准状况下,14 g氮气含有的核外电子数为5NA |
| C、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D、NA个一氧化碳分子和0.5 mol 甲烷的质量比为7:4 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.标准状况下,四氯化碳的状态为液体,不是气体;
B.氮气的摩尔质量为28g/mol,14g氮气的物质的量为0.5mol,氮气分子中含有14个电子;
C.二氧化碳和氧气分子中都含有2个氧原子,NA个由CO2和O2组成的混合物中含有的氧原子数为2NA;
D.NA个一氧化碳分子的物质的量为1mol,质量为28g,0.5mol甲烷的质量为8g.
B.氮气的摩尔质量为28g/mol,14g氮气的物质的量为0.5mol,氮气分子中含有14个电子;
C.二氧化碳和氧气分子中都含有2个氧原子,NA个由CO2和O2组成的混合物中含有的氧原子数为2NA;
D.NA个一氧化碳分子的物质的量为1mol,质量为28g,0.5mol甲烷的质量为8g.
解答:
解:A.标况下,四氯化碳不是气体,不能使用标况下的气体摩尔体积计算5.6L四氯化碳的物质的量,故A错误;
B.14g氮气的物质的量为:
=0.5mol,0.5mol氮气中含有7mol电子,含有的核外电子数为7NA,故B错误;
C.1个CO2分子含有2个氧原子,1个氧气分子也含有2个氧原子,因此NA个由CO2和O2组成的混合物中含有的氧原子数为2NA,故C正确;
D.NA个一氧化碳分子的物质的量为1mol,1molCO的质量为28g,0.5mol甲烷的质量为8g,二者的质量之比为:28g:8g=7:2,故D错误;
故选C.
B.14g氮气的物质的量为:
| 14g |
| 28g/mol |
C.1个CO2分子含有2个氧原子,1个氧气分子也含有2个氧原子,因此NA个由CO2和O2组成的混合物中含有的氧原子数为2NA,故C正确;
D.NA个一氧化碳分子的物质的量为1mol,1molCO的质量为28g,0.5mol甲烷的质量为8g,二者的质量之比为:28g:8g=7:2,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意核外电子与最外层电子的区别.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
下列物质发生化学肥应时,在不同条件下,可得到不同产物的是( )
①P+Cl2②P2O5+H2O③H2S+O2④Na+O2.
①P+Cl2②P2O5+H2O③H2S+O2④Na+O2.
| A、只有①② | B、只有③④ |
| C、只有②③④ | D、全部 |
下列各组混合物中,可以直接用分液漏斗分离的是( )
| A、酒精和碘 | B、苯酚和乙醇 |
| C、乙醇和水 | D、溴乙烷和水 |
已知:P4(s、白磷)+5O2(g)═P4O10(s);△H=-2983.2kJ/mol4P(s、红磷)+5O2(g)═P4O10(s);△H=-2954kJ/mol
那么,1mol红磷转变成相应物质的量白磷时,应是( )
那么,1mol红磷转变成相应物质的量白磷时,应是( )
| A、吸收29.2kJ热量 |
| B、放出29.2kJ热量 |
| C、放出7.3kJ热量 |
| D、吸收7.3kJ热量 |
将装有20mL NO、NO2混合气体的量筒倒立于水槽中,充分反应后量筒内气体体积缩小为10mL,则原混合气体中NO、NO2的体积比是( )
| A、3:2 | B、2:3 |
| C、3:1 | D、1:3 |
已知丁基共有4种,不必试写,立即可断定分子式为C4H10O的醇应有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
已知乙烯分子是平面结构,因此1,2-二氯乙烯可形成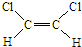 和
和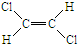 两种不同的空间异构体,称为顺反异构.下列能形成类似上述空间异构体的是( )
两种不同的空间异构体,称为顺反异构.下列能形成类似上述空间异构体的是( )
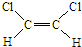 和
和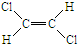 两种不同的空间异构体,称为顺反异构.下列能形成类似上述空间异构体的是( )
两种不同的空间异构体,称为顺反异构.下列能形成类似上述空间异构体的是( )| A、1-丁烯 | B、2-甲基-1-丙烯 |
| C、2-丁烯 | D、丁烷 |
