题目内容
W、X、Y、Z是原子序数依次增大的四种短周期元素(稀有气体除外).其中只有X为金属元素,焰色反应为黄色.W、Y的原子最外层电子数相等,且W的原子最外层电子数是其内层电子数的3倍.请回答:
(1)W在元素周期表中的位置是 .
(2)X的单质与水反应的离子方程式是 .
(3)将0.142g Z的单质与足量的FeSO4溶液反应,被氧化的Fe2+的物质的量为 .
(4)W、X、Y三种元素组成的一种常见化合物甲,其中Y处于其最高化合价.在实验室中,检验甲中阴离子的操作方法和实验现象为:取少量甲的溶液于试管中, ,则证明甲中有该阴离子.
(1)W在元素周期表中的位置是
(2)X的单质与水反应的离子方程式是
(3)将0.142g Z的单质与足量的FeSO4溶液反应,被氧化的Fe2+的物质的量为
(4)W、X、Y三种元素组成的一种常见化合物甲,其中Y处于其最高化合价.在实验室中,检验甲中阴离子的操作方法和实验现象为:取少量甲的溶液于试管中,
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z是原子序数依次增大的四种短周期元素(稀有气体除外).其中只有X为金属元素,焰色反应为黄色,则X为Na;且W的原子最外层电子数是其内层电子数的3倍,W只能有2个电子层,最外层电子数为6,则W为O元素;W、Y的原子最外层电子数相等,Y的原子序数较大,故Y为S元素;Z的原子序数最大,故Z为Cl元素,据此解答.
解答:
解:W、X、Y、Z是原子序数依次增大的四种短周期元素(稀有气体除外).其中只有X为金属元素,焰色反应为黄色,则X为Na;且W的原子最外层电子数是其内层电子数的3倍,W只能有2个电子层,最外层电子数为6,则W为O元素;W、Y的原子最外层电子数相等,Y的原子序数较大,故Y为S元素;Z的原子序数最大,故Z为Cl元素,
(1)W为O元素,在元素周期表中的位置是:第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)X为Na,与水反应生成氢氧化钠与氢气,反应离子方程式是:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)将0.142g 氯气的单质与足量的FeSO4溶液反应,氯气的物质的量=
=0.002mol,根据电子转移守恒,可知被氧化的Fe2+的物质的量=
=0.004mol,故答案为:0.004mol;
(4)O、Na、S三种元素组成的一种常见化合物甲,其中S处于其最高化合价,则甲为Na2SO4,在实验室中,检验甲中阴离子的操作方法和实验现象为:取少量甲的溶液于试管中,滴加盐酸,没有白色沉淀与气体生成,再滴加氯化钡溶液,有白色沉淀生成,则证明甲中有该硫酸根,
故答案为:滴加盐酸,没有白色沉淀与气体生成,再滴加氯化钡溶液,有白色沉淀生成.
(1)W为O元素,在元素周期表中的位置是:第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)X为Na,与水反应生成氢氧化钠与氢气,反应离子方程式是:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)将0.142g 氯气的单质与足量的FeSO4溶液反应,氯气的物质的量=
| 0.142g |
| 71g/mol |
| 0.002mol×2 |
| 3-2 |
(4)O、Na、S三种元素组成的一种常见化合物甲,其中S处于其最高化合价,则甲为Na2SO4,在实验室中,检验甲中阴离子的操作方法和实验现象为:取少量甲的溶液于试管中,滴加盐酸,没有白色沉淀与气体生成,再滴加氯化钡溶液,有白色沉淀生成,则证明甲中有该硫酸根,
故答案为:滴加盐酸,没有白色沉淀与气体生成,再滴加氯化钡溶液,有白色沉淀生成.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,(4)中注意硫酸检验中干扰离子影响,难度中等.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案
相关题目
能用离子方程式H++OH-=H2O表示的化学反应是( )
| A、NaOH溶液和醋酸的反应 |
| B、Ba(OH)2溶液和稀H2SO4的反应 |
| C、NaOH溶液和硫酸氢钠溶液反应 |
| D、氨水和稀H2SO4的反应 |
下列有机反应属于氧化反应的是( )
| A、CH2=CH2+Br2→CH2Br-CH2Br | |||
B、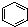 +HNO3 +HNO3
 +H20 +H20 | |||
C、2CH3CH2OH+O2
| |||
D、CH3COOH+CH3CH2OH
|
下列反应既是氧化还原反应,又是吸热反应的是( )
| A、Ba(OH)2?8H2O与NH4Cl的反应 |
| B、铝片与稀硫酸反应 |
| C、甲烷在空气中燃烧 |
| D、灼热的焦炭与CO2反应 |

 Ⅰ.用活性炭还原法处理氮氧化物.有关反应为:
Ⅰ.用活性炭还原法处理氮氧化物.有关反应为: