题目内容
7.据研究,若把太阳光变成激光用于分解海水制氢,反应可表示为:2H2O$\frac{\underline{\;TiO_{2}\;}}{激光}$H2↑+O2↑.有下列几种说法:①水分解反应是放热反应;②氢气是可再生能源;③使用氢气作燃料有助于控制温室效应;④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件.其中叙述正确的是( )| A. | ①② | B. | ③④ | C. | ②③④ | D. | ①②③④ |
分析 ①水分解反应是吸热反应;
②氢气可以通过分解海水制得;
③氢气作燃料燃烧产物为水,温室效应与二氧化碳的排放有关;
④CO2+3H2$\frac{\underline{\;催化剂\;}}{\;}$CH3OH+H2O,可减少二氧化碳的排放,同时储存能源.
解答 解:①把太阳光变成激光用于分解海水制氢,太阳光提供能量,所以,水分解反应是吸热反应,故①错误;
②氢气燃烧生成水,而氢气又可以通过分解海水制得,故可以再生,故②正确;
③温室效应产生的原因是二氧化碳的增多,使用氢气作燃料2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,能减少二氧化碳的含量,有助于控制温室效应,故③正确;
④甲醇是重要的化工原料,也可作燃料,CO2+3H2$\frac{\underline{\;催化剂\;}}{\;}$CH3OH+H2O,可减少二氧化碳的排放,同时储存能源,可改善生存条件,故④正确;
故选C.
点评 本题主要考查了海水制氢,了解能源分类、温室效应抓住题干信息结合相关知识分析是解答的关键,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
17.下列离子方程式书写错误的是( )
| A. | 石灰石溶于稀盐酸:CaCO3+2H+═CO2↑+Ca2++H2O | |
| B. | 钠与冷水反应:Na+2H2O═Na++OH-+H2↑ | |
| C. | 铁与稀盐酸反应:Fe+2H+═H2↑+Fe2+ | |
| D. | 铝粉与氢氧化钠溶液反应:2Al+2H2O+2OH-═2AlO2-+3H2↑ |
18.下列说法不正确的是( )
| A. | 食品保存在冰箱中不易坏,说明温度对反应速率有影响 | |
| B. | 在金属与非金属的分界线附近寻找半导体材料 | |
| C. | 在周期表中,第IA族全部为金属元素 | |
| D. | 金刚石与石墨互为同素异形体 |
2.已知R2-离子核外有a个电子,b个中子.表示R原子符号正确的是( )
| A. | ${\;}_a^bR$ | B. | ${\;}_{a+2}^{a+b+2}R$ | C. | ${\;}_{a-2}^{a+b}R$ | D. | ${\;}_{a-2}^{a+b-2}R$ |
12.下列物质中,含有非极性共价键的是( )
| A. | CaCl2 | B. | CO2 | C. | Na2O2 | D. | CH4 |
16.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2$\stackrel{催化剂}{→}$CO2+H2O.下列有关说法正确的是( )
| A. | 该反应为吸热反应 | B. | CO2的分子模型示意图: | ||
| C. | HCHO分子中既含σ键又含π键 | D. | 每生成1.8 g H2O消耗2.24 L O2 |
17.短周期主族元素W、R、M、X、Y、Z,原子序数依次增大.W、X、Y三种元素原子的最外层电子数之和为15,Y原子核电荷数等于W原子核电荷数的2倍,R原子最外层电子数与X原子最外层电子数相差2.下列叙述正确的是( )
| A. | W与R形成的化合物只能含离子键 | |
| B. | M、X与R的最高价氧化物的水化物所组成的原电池中M作负极 | |
| C. | 简单气态氢化物的沸点:Y<W | |
| D. | 化合物Y2Z2中只含极性共价键 |
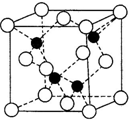 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题: 中.试回答下列问题:
中.试回答下列问题: