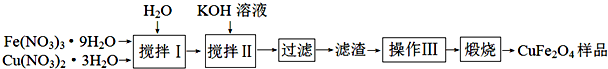
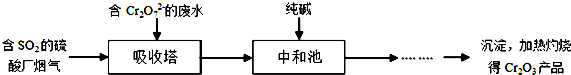
题目内容
13.下列有关说法正确的是( )| A. | 反应CaC2(s)+N2(g)=CaCN2(s)+C(s)能自发进行,是因为△H<0 | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 向水中加入NaHCO3或NaHSO4固体后,水的电离程度均增大 | |
| D. | 对于乙酸乙酯的水解反应,加入稀硫酸会使平衡向正反应方向移动 |
分析 A、该反应为熵减的反应,若能自发,则△H<0;
B、根据原电池原理,活泼的一极为负极,更容易被氧化;
C、根据盐类水解的知识,加酸、碱会抑制水的电离;
D、浓硫酸作催化剂,加稀硫酸使得氢离子浓度增大,平衡逆向移动.
解答 解:A、该反应为熵减的反应,若能自发,则△H<0,故A正确;
B、根据原电池原理,活泼的一极为负极,更容易被氧化,铝比铜活泼,故B错误;
C、根据盐类水解的知识,加酸、碱会抑制水的电离,NaHSO4中的氢离子完全电离,会抑制水的电离,故C错误;
D、浓硫酸作催化剂,加稀硫酸使得氢离子浓度增大,平衡逆向移动,故D错误.
故选:A.
点评 本题考查了反应是否能自发进行的依据、盐类的水解、弱电解质的电离平衡及平衡移动原理,难度不大,要求学生有扎实的基础.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
4.大气污染越来越成为人们关注的问题,工业生产尾气中的氮氧化物必须脱除(即脱
硝)后才能排放.
(1)已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ•mol-1 ①
N2(g)+O2(g)═2NO(g);△H=+180kJ•mol-1 ②
CH4可用于硝,其热化学方程式为CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H3 ③
已知反应①中的相关的化学键键能数据如下:
由此计算△H3=-1150kJ.mol-1,C-H化学键键能E=414kJ.mol-1.
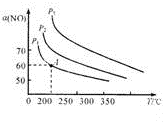
(2)反应2CO (g)+2NO(g)═N2(g)+2CO2(g)也可用于脱硝,图1为该反应过程中
NO的平衡转化率a(NO)与温度、压强的关系[其中初始c(CO)和c(NO)均为1mol.L-1],计算该反应在200cC时的平衡常数K=4.22(mol/L)-1,图中压强(P1、P2、P3)的大小顺序为P3>P2>P1.
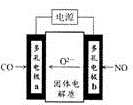
(3)有人利用电化学方法将CO和NO转化为无毒物质.装置如图2所示
①电极a是阳极;
②电极b的电极反应式是2NO+4e-═N2+2O2-.
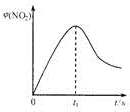
(4)新型臭氧氧化技术利用具有极强氧化性的0,对尾气中的NO脱除,反应为NO(g)+O3(g)=NO2(g)+O2(g),在一定条件下,将NO和0,通人密闭容器中并不断加热发生反应(温度不超过各物质的分解温度),NO2的体积分数妒(NO2)随时间变化如图3所示,可以发现t1s后NO.的体积分数下降,其可能的原因是该反应是放热反应研究小组通过增大$\frac{n({O}_{3})}{n(NO)}$比值提高NO的平衡转化率,却发现当$\frac{n({O}_{3})}{n(NO)}$>1时,NO2的物质的量减小,可能原因是O3将NO2氧化为更高价氮氧化物(或生成了N2O5).
硝)后才能排放.
(1)已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJ•mol-1 ①
N2(g)+O2(g)═2NO(g);△H=+180kJ•mol-1 ②
CH4可用于硝,其热化学方程式为CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H3 ③
已知反应①中的相关的化学键键能数据如下:
| 化学键 | O=O | C=O | H=O | C=H |
| E/(kJ mol-1) | 496 | 799 | 460 | ? |
(2)反应2CO (g)+2NO(g)═N2(g)+2CO2(g)也可用于脱硝,图1为该反应过程中
NO的平衡转化率a(NO)与温度、压强的关系[其中初始c(CO)和c(NO)均为1mol.L-1],计算该反应在200cC时的平衡常数K=4.22(mol/L)-1,图中压强(P1、P2、P3)的大小顺序为P3>P2>P1.
 |  |  |
| 图1 | 图2 | 图3 |
①电极a是阳极;
②电极b的电极反应式是2NO+4e-═N2+2O2-.
(4)新型臭氧氧化技术利用具有极强氧化性的0,对尾气中的NO脱除,反应为NO(g)+O3(g)=NO2(g)+O2(g),在一定条件下,将NO和0,通人密闭容器中并不断加热发生反应(温度不超过各物质的分解温度),NO2的体积分数妒(NO2)随时间变化如图3所示,可以发现t1s后NO.的体积分数下降,其可能的原因是该反应是放热反应研究小组通过增大$\frac{n({O}_{3})}{n(NO)}$比值提高NO的平衡转化率,却发现当$\frac{n({O}_{3})}{n(NO)}$>1时,NO2的物质的量减小,可能原因是O3将NO2氧化为更高价氮氧化物(或生成了N2O5).
18.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.下列叙述错误的是( )
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与题中其他元素生成的化合物都是离子化合物 | |
| D. | c、d形成的气态氢化物的还原性:d>c |
2.下列离子方程式书写正确的是( )
| A. | 硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水中加少量碳酸氢钠:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO32+H3O+?HCO3-+H2O3O+ |
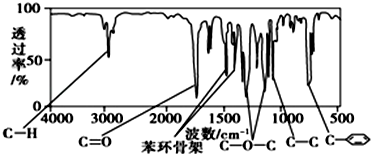
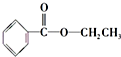 、
、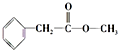 ;
;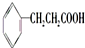 .
.