题目内容
9.氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )| A. | 使新鲜的红玫瑰花褪色(HCl) | B. | 新制氯水呈浅黄绿色(Cl2) | ||
| C. | 加入小苏打固体,有气泡产生(H+) | D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
分析 氯气与水反应,发生Cl2+H2O=H++Cl-+HClO,氯水中含有HClO、Cl2,具有氧化性,其中HClO具有漂白性,含有H+,具有酸性,以此解答.
解答 解:A.次氯酸具有强氧化性,可使红玫瑰花褪色,故A错误;
B.氯气是黄绿色气体,新制氯水中含有氯气,使得新制氯水呈浅黄绿色,故B正确;
C.新制氯水显酸性,能与碳酸氢钠反应生成CO2气体,故C正确;
D.新制氯水中的氯离子和硝酸银反应生成氯化银白色沉淀,故D正确;
故选A.
点评 本题考查新制氯水的成分和性质,为高频考点,难度大不,注意把握新制氯水和久置氯水成分的区别.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
2.在实验室中不宜用硫酸制备( )
| A. | 氢气 | B. | 二氧化碳 | C. | 氯化氢 | D. | 硫化氢 |
17.CO(g)+Cl2(g)?COCl2(g)△H<0.当反应达到平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO的浓度;④加压;⑤加催化剂;⑥恒压通入惰性气体.能使CO体积分数增大的是( )
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ①③⑥ |
4. 在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
(1)仅依据K的变化可推断出随着卤素原子核电荷数的增加cd(填字母)
a.HX的还原性逐渐减弱 b.X2与H2反应的剧烈程度逐渐减弱
c.HX的稳定性逐渐减弱 d.在相同条件下,X2的平衡转化率逐渐降低
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如图所示:
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=$\frac{{n}_{A}}{6{t}_{A}}$mol/(L•min)
②分析图象,下列说法正确的是a、b(填序号)
a.平衡常数K随温度的升高而变小 b.正反应为放热反应
c.只有当反应进行到A点或B点所示状态时,容器内气体密度才不再发生变化
(3)已知氢氟酸(HF)是弱酸,加水稀释0.1mol•L-1HF溶液,下列各量中增大的是D(填序号)
a.c(H+) b.HF的电离常数 c.c(F-)/c(H+) d.c(H+)/c(HF)
(4)向盛有10滴0.1mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液至不再有白色沉淀生成,向其中再滴加0.1mol•L-1KI溶液,出现了黄色沉淀.请简要解释此现象的原因:AgI溶解度比AgCl溶解度小,使AgCl(s)?Ag+(aq)+Cl-(aq)体系中c(Ag+)减小,使平衡向右移动.
 在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:
在温度T1和T2下,X2(g)和H2(g)反应生成HX(g)的平衡常数K如下表:| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
a.HX的还原性逐渐减弱 b.X2与H2反应的剧烈程度逐渐减弱
c.HX的稳定性逐渐减弱 d.在相同条件下,X2的平衡转化率逐渐降低
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如图所示:
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=$\frac{{n}_{A}}{6{t}_{A}}$mol/(L•min)
②分析图象,下列说法正确的是a、b(填序号)
a.平衡常数K随温度的升高而变小 b.正反应为放热反应
c.只有当反应进行到A点或B点所示状态时,容器内气体密度才不再发生变化
(3)已知氢氟酸(HF)是弱酸,加水稀释0.1mol•L-1HF溶液,下列各量中增大的是D(填序号)
a.c(H+) b.HF的电离常数 c.c(F-)/c(H+) d.c(H+)/c(HF)
(4)向盛有10滴0.1mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液至不再有白色沉淀生成,向其中再滴加0.1mol•L-1KI溶液,出现了黄色沉淀.请简要解释此现象的原因:AgI溶解度比AgCl溶解度小,使AgCl(s)?Ag+(aq)+Cl-(aq)体系中c(Ag+)减小,使平衡向右移动.
1.当不慎有大量Cl2逸到周围空气里时,可用浸有一定浓度的下列物质溶液的毛巾捂住鼻子,该物质是( )
| A. | NaOH | B. | NaCl | C. | NH3•H2O | D. | NaHCO3 |
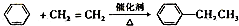
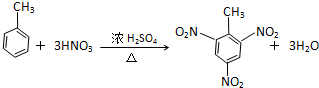 .
. .
. ,结构式是F-O-O-O-F.
,结构式是F-O-O-O-F.