题目内容
可用于分离或提纯物质的方法有:
A.过滤 B.升华 C.加热分解 D.洗气法 E.分液法 F.蒸馏(分馏)法
下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填序号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,用 ;
(2)除去O2中少量的水蒸气,用 ;
(3)除去固体食盐中混有的少量I2,用 ;
(4)除去氧化钙中的CaCO3,用 ;
(5)水和汽油的混合物,用 ;
(6)CCl4液体与甲苯液体的混合物(已知CCl4与甲苯互溶,沸点分别为76.75℃和110.6℃),用 .
A.过滤 B.升华 C.加热分解 D.洗气法 E.分液法 F.蒸馏(分馏)法
下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填序号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,用
(2)除去O2中少量的水蒸气,用
(3)除去固体食盐中混有的少量I2,用
(4)除去氧化钙中的CaCO3,用
(5)水和汽油的混合物,用
(6)CCl4液体与甲苯液体的混合物(已知CCl4与甲苯互溶,沸点分别为76.75℃和110.6℃),用
考点:物质的分离、提纯的基本方法选择与应用
专题:
分析:(1)碳酸钙不溶于水,而氢氧化钙溶于水;
(2)浓硫酸可吸收水,与氧气不反应;
(3)碘易升华,而NaCl不能;
(4)碳酸钙分解生成CaO;
(5)水和汽油的混合物分层;
(6)CCl4与甲苯互溶,但沸点不同.
(2)浓硫酸可吸收水,与氧气不反应;
(3)碘易升华,而NaCl不能;
(4)碳酸钙分解生成CaO;
(5)水和汽油的混合物分层;
(6)CCl4与甲苯互溶,但沸点不同.
解答:
解:(1)除去石灰水中悬浮的CaCO3颗粒,根据CaCO3的溶解性,是不溶于水的物质,要和石灰水分离,可以采用过滤的方法,故答案为:A;
(2)浓硫酸具有吸水性且与氧气不反应,可以用浓硫酸来洗气,故答案为:D;
(3)碘单质受热易升华,而碘化钠受热稳定,可以用加热升华法来分离,故答案为:B;
(4)碳酸钙受热分解为氧化钙、二氧化碳,而氧化钙受热稳定,故可以用加热分解法来分离,故答案为:C;
(5)水和汽油的混合物分层,则选择分液法分离,故答案为:E;
(6)CCl4与甲苯互溶,但沸点不同,则选择蒸馏法分离,故答案为:F.
(2)浓硫酸具有吸水性且与氧气不反应,可以用浓硫酸来洗气,故答案为:D;
(3)碘单质受热易升华,而碘化钠受热稳定,可以用加热升华法来分离,故答案为:B;
(4)碳酸钙受热分解为氧化钙、二氧化碳,而氧化钙受热稳定,故可以用加热分解法来分离,故答案为:C;
(5)水和汽油的混合物分层,则选择分液法分离,故答案为:E;
(6)CCl4与甲苯互溶,但沸点不同,则选择蒸馏法分离,故答案为:F.
点评:本题考查混合物分离提纯的方法及应用,为高频考点,把握物质的性质及性质差异为解答的关键,注意分离方法的选择与物质性质有关,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1.已知反应的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L;5min后反应达平衡,此时CO的转化率为50%.则下列说法正确的是( )
| A、该反应属于熵增放热反应,一定能自发进行 |
| B、5 min内H2的平均反应速率为0.1 mol/(L?min) |
| C、其它条件不变的情况下,加入催化剂可提高CO的转化率 |
| D、若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4 |
一定条件下,充分燃烧一定量的丁烷放出热量161.9kJ,经测定完全吸收生成的CO2需消耗5mol/L的KOH溶液100ml,恰好生成正盐,则此条件下热化学方程式:C4H10(g)+
O2(g)→4CO2(g)+5H2O(g)的△H为( )
| 13 |
| 2 |
| A、+2590.4kJ/mol |
| B、-2590.4kJ/mol |
| C、+1295.2kJ/mol |
| D、-1295.2kJ/mol |
下列实验操作中有错误的是( )
| A、蒸馏时,冷凝水应从冷凝管的下口通入、上口流出且将温度计水银球插入液体中 |
| B、分液时,分液漏斗下层液体从下口放出,上层液体也从下口放出 |
| C、萃取时,萃取剂的选取与密度无关 |
| D、蒸发时,当溶液中出现少量固体应停止加热,利用余热蒸干剩余溶液 |
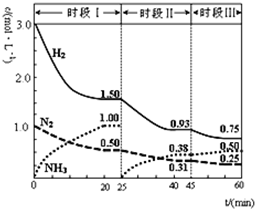 N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法正确的是( )
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图示.下列说法正确的是( )| A、前20分钟反应内放出的热量为46.2kJ |
| B、第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C、若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是增大压强 |
| D、时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |