题目内容
(1)简述氢氧化铁胶体的制备方法 ; 制备原理(用化学方程式表示) .
(2)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是 ,R的相对原子质量是 ,R元素的符号 ,该物质中含质子数目为 .(NA表示阿常数的值)
(2)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是
考点:胶体的重要性质,摩尔质量,质量数与质子数、中子数之间的相互关系
专题:
分析:(1)氢氧化铁胶体的制备是在沸水中滴加饱和氯化铁溶液加热到红褐色液体得到氢氧化铁胶体;
(2)根据公式n=
来计算M,M在数值上等于元素的相对原子质量,分子的M在数值上等于其相对分子质量;1molRSO4中含60mol质子.
(2)根据公式n=
| m |
| M |
解答:
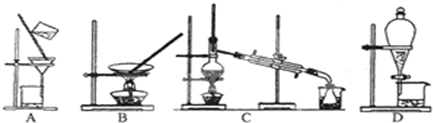
解:(1)实验室制备氢氧化铁胶体的方法是在沸水中滴加饱和氯化铁溶液加热,得到红褐色液体为氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O═Fe(OH)3(胶体)+3HCl,
故答案为:往烧杯中沸腾的蒸馏水内逐滴滴入饱和的FeCl3溶液,当烧杯中液体成为红棕色时停止加热;FeCl3+3H2O═Fe(OH)3(胶体)+3HCl;
(2)已知1.2gRSO4中含0.01molR2+,则RSO4的物质的量为0.01mol,RSO4的摩尔质量是
=120g/mol,R的相对原子质量是120-96=24,R元素的符号Mg,1molRSO4中含60mol质子,0.01mol该物质中含质子数目为0.01mol×60=0.6mol,含质子数目为0.6 NA,
故答案为:120g/mol;24;Mg;0.6 NA.
故答案为:往烧杯中沸腾的蒸馏水内逐滴滴入饱和的FeCl3溶液,当烧杯中液体成为红棕色时停止加热;FeCl3+3H2O═Fe(OH)3(胶体)+3HCl;
(2)已知1.2gRSO4中含0.01molR2+,则RSO4的物质的量为0.01mol,RSO4的摩尔质量是
| 1.2g |
| 0.01mol |
故答案为:120g/mol;24;Mg;0.6 NA.
点评:本题考查胶体的性质、物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知:

则符合要求的C5H10O2的结构有( )

则符合要求的C5H10O2的结构有( )
| A、1种 | B、2种 | C、4种 | D、5种 |
下列电离方程式中正确的是( )
| A、Na2CO3?2Na++CO32- |
| B、H2CO3?2H++CO32- |
| C、NH3?H2O?NH3+H2O |
| D、H2SO3?H++HSO3- |
下列电离方程式的书写正确的是( )
| A、Na2CO3=2Na++CO32- |
| B、CuCl2=Cu+Cl2↑ |
| C、NaHCO3=Na++H++CO32- |
| D、Ba(OH)2=Ba+2OH- |
需要配制2mol/L的NaOH溶液950mL,应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A、950mL,111.2g |
| B、500mL,117g |
| C、1000mL,117g |
| D、任意规格,111.2g |