题目内容
15.请按要求回答下列问题:(1)现有以下物质:①NaHCO3固体 ②液态SO3③BaSO4晶体 ④蔗糖 ⑤盐酸 ⑥铜⑦KOH溶液 ⑧H2SO3⑨H2O.其中属于强电解质的是:①③,属于非电解质的是:②④.属于弱电解质的是:⑧⑨.
(2)液化石油气的主要成分为丁烷,已知1g丁烷完全燃烧生成液态水和二氧化碳放出50kJ的热量,写出反应的热化学方程式C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2900kJ/mol;
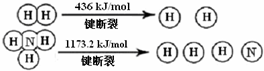
(3)氨气是生产化肥、硝酸等的重要原料,合成搭中每生产1molNH3,放出46.2KJ热量.断裂1mol N≡N键需要能量946KJ
(4)1000℃时硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).
该反应的平衡常数表达式为K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$
已知K1000℃<K1200℃,则该反应是吸热反应(填“吸热”或“放热”).
分析 (1)在水溶液里或熔融状态下能导电的化合物是电解质,
在水溶液里和熔融状态下都不导电的化合物是非电解质,
单质和混合物既不是电解质也不是非电解质;
能够完全电离的电解质是强电解质,只能部分电离的电解质是弱电解质;
(2)已知1g丁烷完全燃烧生成液态水和二氧化碳放出50kJ的热量,1mol丁烷完全燃烧生成液态水和二氧化碳放出的热量=2900KJ,注意物质的聚集状态和对应反应焓变写出热化学方程式;
(3)依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算得到;
(4)依据平衡常数概念写出表达式K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,温度升高平衡常数增大,说明反应是吸热反应.
解答 解:(1)①NaHCO3固体是强电解质,
②液态SO3 自身不能电离出离子属于非电解质,
③BaSO4晶体熔融状态导电属于强电解质,
④蔗糖溶于水和熔融状态都不能导电属于非电解质,
⑤盐酸是氯化氢的水溶液属于电解质溶液,
⑥铜是单质不是电解质或非电解质,
⑧H2SO3溶于水发生部分电离,溶液导电,属于弱电解质,
⑨H2O发生微弱电解质属于弱电解质,
其中属于强电解质的是①③,
属于非电解质的是②④,
属于弱电解质的是⑧⑨,
故答案为:①③;②④;⑧⑨;
(2)已知1g丁烷完全燃烧生成液态水和二氧化碳放出50kJ的热量,1mol丁烷完全燃烧生成液态水和二氧化碳放出的热量=2900KJ,则热化学方程式为:
C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2900kJ/mol,
故答案为:C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-2900kJ/mol;
(3)反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+1mol N≡N键能-6×N-H键键能=-92.4,由图知N-H键键能=391KJ,所以断裂1mol N≡N键需要能量是946KJ,
故答案为:946;
(4)Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),依据反应写出平衡常数K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$,已知K1000℃<K1200℃,温度升高平衡常数增大,则该反应是吸热反应,
故答案为:$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$;吸热.
点评 本题考查了电解质和非电解质,强电解质,弱电解质的判断,热化学方程式书写、键能计算反应焓变、化学平衡常数及其影响因素等知识,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案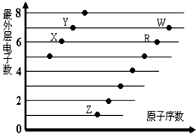
| A. | X与Z两种元素形成的化合物一定是离子化合物,有且只有离子键 | |
| B. | RX2、WX2、Z2X2都能使品红溶液褪色,且褪色原理相同 | |
| C. | R、W所形成的氧化物的水化物的酸性强弱为W>R | |
| D. | X、Y、R、W四种元素形成的气体氢化物中最稳定的是 Y 的气态氢化物 |
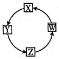 X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是
X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是| 选项 | X | Y | Z | W |
| A | Na | Na2O2 | NaOH | NaCl |
| B | H2S | SO2 | SO3 | H2SO4 |
| C | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
| D | AlCl3 | NaAlO2 | Al(OH)3 | Al |
| A. | A | B. | B | C. | C | D. | D |
| 操作 | 现象 |
| 向盛有4gNa2O2的烧杯中加入50mL蒸馏水得到溶液a | 剧列反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应.
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
Ⅱ.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量:取15.00mL溶液a,用稀H2SO4酸化,逐滴加入0.003mol•L-1KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00mLKMnO4溶液.
①请配平:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O
②溶液a中c(H2O2)=0.01mol•L-1.
③溶液褪色速率开始较慢后变快的原因可能是反应生成的Mn2+作催化剂.
(3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:
Ⅲ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1mol•L-1NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色.
Ⅳ.向0.1mol•L-1NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化.
①从实验Ⅲ和Ⅳ中,可得出的结论是碱性条件下,H2O2能与酚酞反应而O2不能.
②同学们进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应.实验方案是:取少量溶液a于试管中,加入MnO2,充分反应后,向上层清液中滴入2滴酚酞后变红,10分钟后,溶液颜色无明显变化.
| A. | 前者大于后者 | B. | 前者小于后者 | C. | 相等 | D. | 不能确定 |
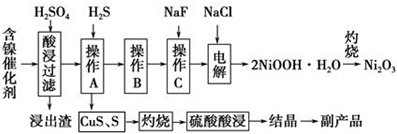
已知常温下:①有关氢氧化物开始沉淀和沉淀完pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
| A. | 通入CH4的电极为正极 | |
| B. | 正极的电极反应式为O2+4H++4e-═2H2O | |
| C. | 通入CH4的一极的电极反应式为CH4+2O2+4e-═CO2+2H2O | |
| D. | 负极的电极反应式为CH4+10OH--8e-═CO32-+7H2O |
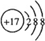 ,
,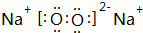 ,用电子式表示C2B的形成过程
,用电子式表示C2B的形成过程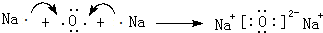
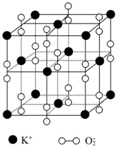 如图所示是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元).晶体中氧的化合价可看作是部分为0价,部分为-2价.
如图所示是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元).晶体中氧的化合价可看作是部分为0价,部分为-2价.