题目内容
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、c(H+)=c(OH-)=10-6mol/L溶液 |
| C、由强酸、强碱等物质的量反应后得到的溶液 |
| D、滴入甲基橙指示剂显橙色的溶液 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,当溶液中:c(H+)>c(OH-),溶液呈酸性;c(H+)=c(OH-),溶液呈中性;c(H+)<c(OH-),溶液呈碱性;常温下,水的离子积Kw=1×10-14,所以,pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性.Kw受温度影响,水的电离是吸热反应,温度越高Kw越大,据此进行判断.
解答:
解:A、pH=7的溶液,不一定是常温下,水的离子积不一定是Kw=1×10-14,溶液中c(H+)、c(OH-)不一定相等,故A错误;
B、溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,溶液中氢离子浓度大于氢氧根离子浓度,溶液一定显示中性,故B正确;
C、由强酸与强碱等物质的量反应得到的溶液,若氢离子浓度物质的量与氢氧根离子的物质的量不相等,反应后溶液不会显示中性,故C错误;
D、酚酞的变色范围是8-10,酚酞显示无色,溶液有可能显示碱性,故D错误;
故选:B.
B、溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,溶液中氢离子浓度大于氢氧根离子浓度,溶液一定显示中性,故B正确;
C、由强酸与强碱等物质的量反应得到的溶液,若氢离子浓度物质的量与氢氧根离子的物质的量不相等,反应后溶液不会显示中性,故C错误;
D、酚酞的变色范围是8-10,酚酞显示无色,溶液有可能显示碱性,故D错误;
故选:B.
点评:本题考查了溶液酸碱性的判断,溶液的酸碱性是由溶液中H+浓度与OH-浓度的相对大小决定的,而不在于c(H+)或c(OH-)绝对值的大小.

练习册系列答案
相关题目
关于铅蓄电池的说法正确的是( )
| A、在放电时,电池中硫酸的浓度不断变小 |
| B、在放电时,正极发生的反应是Pb(s)+SO42-(aq)=PbSO4(s)+2e- |
| C、在充电时,电池中阴极质量不断变小 |
| D、在充电时,阳极发生的反应是 PbSO4(s)+2e-=Pb(s)+SO42-(aq) |
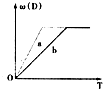 已知下列化学反应:3A(g)+B(g)?C(s)+4D(g)△H<0中a、b分别表示在一定条件下D的体积分数[ω(D)]随反应时间T的变化情况.若使曲线b变为曲线a,可采用的措施是( )
已知下列化学反应:3A(g)+B(g)?C(s)+4D(g)△H<0中a、b分别表示在一定条件下D的体积分数[ω(D)]随反应时间T的变化情况.若使曲线b变为曲线a,可采用的措施是( )| A、增大B的浓度 |
| B、升高温度 |
| C、缩小容器体积 |
| D、降低温度 |
下列关于反应2S02(g)+O2(g)?2S03(g)△H<0的说法正确的是( )
| A、升温可以加快合成SO3的速率同时提高SO2的转化率 |
| B、寻找常温下的合适催化剂是未来研究的方向 |
| C、由于△H<0,△S<0,故该反应一定能自发进行 |
| D、当v(O2)生成?2v(SO3)消耗时,说明反应达到平衡状态 |
常温下,分别将四块形状相同,质量均为7g的铁片同时放入下列四种溶液中,产生H2的速率最快的是( )
| A、500mL2mol?L-1稀硫酸 |
| B、150mL5mol?L-1稍酸 |
| C、50mL3mol?L-1盐酸 |
| D、500mL2mol?L-1稀硫酸和少量硫酸铜 |
下列说法正确的是( )
| A、干冰升华要吸收大量的热,这就是化学反应中的吸热反应 |
| B、凡是在加热或点燃条件下进行的反应都是吸热反应 |
| C、人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 |
| D、明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 |
 【化学--选修5有机化学基础】
【化学--选修5有机化学基础】