题目内容
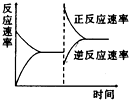 如图是关于反应A2(g)+3B2(g)?2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
如图是关于反应A2(g)+3B2(g)?2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )| A、升高温度,同时加压 |
| B、降低温度,同时减压 |
| C、增大反应物浓度,同时减小生成物浓度 |
| D、增大反应物浓度,同时使用催化剂 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、升高温度,同时加压,正逆反应速率都增大,升高温度,使平衡向逆反应移动,增大压强,使平衡向正反应移动,平衡可能不移动,可能向正反应移动,可能向逆反应移动;
B、降低温度,同时减压正逆反应速率都降低,降低温度,使平衡向正反应移动,减小压强,使平衡向逆反应移动,平衡可能不移动,可能向正反应移动,可能向逆反应移动;
C、增大反应物浓度,同时减小生成物浓度,瞬间正反应速率增大,逆反应速率减小,平衡向正反应移动;
D、增大反应物浓度,同时使用催化剂,正逆反应速率都增大,但正反应速率增大更多,平衡向正反应移动.
B、降低温度,同时减压正逆反应速率都降低,降低温度,使平衡向正反应移动,减小压强,使平衡向逆反应移动,平衡可能不移动,可能向正反应移动,可能向逆反应移动;
C、增大反应物浓度,同时减小生成物浓度,瞬间正反应速率增大,逆反应速率减小,平衡向正反应移动;
D、增大反应物浓度,同时使用催化剂,正逆反应速率都增大,但正反应速率增大更多,平衡向正反应移动.
解答:
解:A、升高温度,同时加压,正逆反应速率都增大,逆反应速率应在原速率的上方,故A错误;
B、降低温度,同时减压正逆反应速率都降低,正反应速率应在原速率的下方,故B错误;
C、增大反应物浓度,同时减小生成物浓度,瞬间正反应速率增大,逆反应速率减小,平衡向正反应移动,图象符合,故C正确;
D、增大反应物浓度,同时使用催化剂,正逆反应速率都增大,逆反应速率应在原速率的上方,但正反应速率增大更多,平衡向正反应移动,故D错误.
故选:C.
B、降低温度,同时减压正逆反应速率都降低,正反应速率应在原速率的下方,故B错误;
C、增大反应物浓度,同时减小生成物浓度,瞬间正反应速率增大,逆反应速率减小,平衡向正反应移动,图象符合,故C正确;
D、增大反应物浓度,同时使用催化剂,正逆反应速率都增大,逆反应速率应在原速率的上方,但正反应速率增大更多,平衡向正反应移动,故D错误.
故选:C.
点评:本题考查了外界条件对化学反应速率和平衡的影响、平衡移动图象,难度较大,明确温度、压强、浓度变化引起化学反应速率变化是解本题的关键.

练习册系列答案
相关题目
 25℃时,20mL0.1mol?L-1氨水溶液中逐滴加入0.2mol?L-1HCl溶液(如图),下列说法正确的是( )
25℃时,20mL0.1mol?L-1氨水溶液中逐滴加入0.2mol?L-1HCl溶液(如图),下列说法正确的是( )| A、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、在C点,c<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) |
| C、若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12 |
| D、在D点:c(NH4+)+c(NH3?H2O)=2c(Cl-) |
在体积一定的密闭容器中,加入镍粉并充入一定体积的CO,发生反应:Ni(s)+4CO(g)?Ni(CO)(g),已知该反应平衡常数与温度的关系如表:下列说法正确的是( )
| 温度℃ | 25 | 80 |
| 平衡常数 | 5×104 | 2 |
| A、上述反应的正反应为吸热反应 |
| B、25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数也为5×104 |
| C、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为1mol.L-1,则此时v(正)>v(逆) |
| D、达平衡后,在容器中再加入一定的Ni粉,则平衡会向正反应方向移动 |
在2A(g)+B(g)?3C(g)+4D(g)中,表示该反应速率最快的是( )
| A、v(A)=5.0mol?L-1?min-1 |
| B、v(B)=2.0mol?L-1?min-1 |
| C、v(C)=0.9mol?L-1?s-1 |
| D、v(D)=1.0mol?L-1?s-1 |
下列关于化学反应限度的说法中正确的是( )
| A、任何一个化学反应都能达到一个化学平衡状态 |
| B、当可逆反应在一定条件下达到最大限度是,正反应速率和逆反应速率相等 |
| C、平衡状态是一种静止的状态 |
| D、化学反应的限度不可能通过改变外界条件而改变 |
下图有关电化学的示意图正确的是( )
A、 |
B、 |
C、 |
D、 |
 +CH2=CH-R
+CH2=CH-R  +HX属于相同反应类型的是( )
+HX属于相同反应类型的是( )



 离子交换膜是一类具有离子交换功能的高分子材料,在生产和科研中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:
离子交换膜是一类具有离子交换功能的高分子材料,在生产和科研中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示: