题目内容
下列说法正确的是( )
| A、标准状况下,1mol H2O和1mol H2的体积都约为22.4L |
| B、2g H2和44g CO2的体积相等 |
| C、1mol任何气体的体积均为22.4L |
| D、标准状况下,1g H2和11.2L O2的物质的量相等 |
考点:物质的量的相关计算
专题:计算题
分析:根据n=
=
结合物质存在的条件、状态解答该题.
| m |
| M |
| V |
| Vm |
解答:
解:A.标准状况下水为液体,与等物质的量的氢气的体积不同,故A错误;
B.气体存在的条件未知,不能确定体积是否相等,故B错误;
C.只有在标准状况下才符合,故C错误;
D.n(H2)=
=0.5mol,n(O2)=
=0.5mol,故D正确.
故选D.
B.气体存在的条件未知,不能确定体积是否相等,故B错误;
C.只有在标准状况下才符合,故C错误;
D.n(H2)=
| 1g |
| 2g/mol |
| 11.2L |
| 22.4L/mol |
故选D.
点评:本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
在密闭容器中充入4mol A,在一定温度和体积可变的密闭容器中发生如下反应:4A(g)═3B(g)+C(g)△H<0,达到平衡时有30%的A发生反应,下列判断正确的是( )
| A、若向密闭体系内再加入3mol B、2mol C,达平衡时C的百分含量与原平衡相同 |
| B、达到平衡时气体的总物质的量、密度都不发生变化 |
| C、反应达平衡的过程中,释放出的热量不发生变化 |
| D、升高温度A的转化率大于30% |
根据以下叙述制备氯化铜:将含有FeO杂质的CuO粉末慢慢加入浓盐酸中,充分反应后粉末溶解.已知:FeS不溶于水,但溶于强酸.
在除去溶液中的Fe2+时,可采用的方法是( )
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥9.6 | ≥6.4 |
| A、加入纯铜粉,将Fe2+还原为Fe |
| B、直接加NaOH溶液,调整溶液的pH≥9.6 |
| C、先将Fe2+氧化成Fe3+,再调整溶液pH至3.7~4 |
| D、通入H2S使Fe2+直接沉淀 |
在元素周期表中,第二、第三、第四、第五、第六周期元素的种数分别是( )
| A、8、8、18、18、36 |
| B、8、8、18、32、32 |
| C、8、8、18、18、32 |
| D、8、18、18、36、36 |
下列离子方程式书写正确的是( )
| A、等物质的量的CO2与氢氧化钠溶液反应:CO2+2OH-═CO32-+H2O | ||||
| B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | ||||
| C、氢氧化钙溶液与等物质的量的稀H2SO4混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O | ||||
D、用石墨电极电解饱和食盐水:2H2O+2Cl-
|
下列表示反应中电子转移的方向和数目正确的是( )
A、 |
B、 |
C、 |
D、 |
常温下,等物质的量浓度的溶液:①烧碱溶液;②硝酸钾溶液;③硫酸氢铵溶液;④碳酸氢钠溶液;⑤碳酸钠溶液;⑥硫酸铵溶液,其pH由小到大的排序正确的是( )
| A、①②④③⑤⑥ |
| B、⑥⑤④③②① |
| C、③⑥②④⑤① |
| D、⑥③②⑤④① |
设NA为阿伏加德罗常数的值,下列对0.3mol/L K2SO4溶液的正确说法是( )
| A、1L溶液中含有0.4NA个钾离子 |
| B、1L溶液中含有K+离子和SO42-离子总数为0.9NA |
| C、2L溶液中钾离子的浓度为1.2mol/L |
| D、2L溶液中含有0.3NA个SO42-离子 |
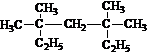 系统命名为
系统命名为