题目内容
 化学反应原理在生活和生产中有着广泛的应用.利用“化学蒸气转移法”制备TaS2晶
化学反应原理在生活和生产中有着广泛的应用.利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:TaS2(s)+2I2(g)═TaI4(g)+S2(g)-Q (Ⅰ)
(1)在一定温度下进行上述反应,若反应容器的容积为2L,2min后达到平衡,测得固体的质量减少了4.9g,则I2的平均反应速率
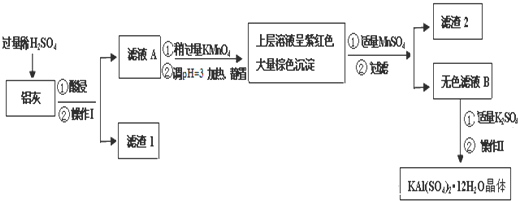
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1
(3)在一定条件下,能判断反应( I)在密闭容器中一定达化学平衡状态的是
a.v (I2)(正)=2v (S2)(逆)
b.TaI4和I2的浓度相等
c.容器内气体物质的量保持不变
d.混合气体的平均分子量保持不变
胃液本身就是酸性的,正常的胃液pH大约为2.5左右.当保护胃的黏膜分解,胃酸侵蚀到胃壁,就会导致胃溃疡,使用一些抗酸剂可以加快治愈的进度.碳酸氢钠片、达喜都是常用的抗酸剂.
(4)已知碳酸氢钠溶液显碱性,该溶液中CO32-与H2CO3浓度之比
(5)碳酸氢钠溶液与硫酸铝溶液混合剧烈反应,产生白色沉淀并放出气体,可以利用此原来进行灭火.此反应的离子方程式为
(6)达喜通用名称:铝碳酸镁片,化学成分是铝和镁的碱式碳酸盐.取达喜3.01g,加入2.0mol?L-1
盐酸使其溶解,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时正好反应完全,则达喜中氢氧根与碳酸根的物质的量之比
考点:化学平衡的计算,化学方程式的有关计算,化学平衡状态的判断,盐类水解的应用
专题:基本概念与基本理论
分析:(1)利用差量法根据反应速率的计算公式V=
计算;
(2)通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断,注意选择的物理量随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(4)根据碳酸氢钠溶液显碱性,说明水解大于电离,又水解生成碳酸,电离生成碳酸根,所以CO32-与H2CO3浓度之比<1;
(5)发生相互促进水解反应,生成氢氧化铝、二氧化碳、硫酸钠;
(6)加入盐酸生成二氧化碳,可知该药物为铝和镁的碱式碳酸盐,反应过程为:先发生H++OH-═H2O,再发生CO32-+H+═HCO3-,最后发生HCO3-+H+═CO2↑+H2O,从42.5mL~45.0mL消耗2.5mL盐酸,发生反应HCO3-+H+═CO2↑+H2O,根据方程式计算n(HCO3-)、n(CO32-),进而计算HCO3-、CO32-消耗的氢离子物质的量,进而计算n(OH-),据此解答.
| △c |
| △t |
(2)通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断,注意选择的物理量随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(4)根据碳酸氢钠溶液显碱性,说明水解大于电离,又水解生成碳酸,电离生成碳酸根,所以CO32-与H2CO3浓度之比<1;
(5)发生相互促进水解反应,生成氢氧化铝、二氧化碳、硫酸钠;
(6)加入盐酸生成二氧化碳,可知该药物为铝和镁的碱式碳酸盐,反应过程为:先发生H++OH-═H2O,再发生CO32-+H+═HCO3-,最后发生HCO3-+H+═CO2↑+H2O,从42.5mL~45.0mL消耗2.5mL盐酸,发生反应HCO3-+H+═CO2↑+H2O,根据方程式计算n(HCO3-)、n(CO32-),进而计算HCO3-、CO32-消耗的氢离子物质的量,进而计算n(OH-),据此解答.
解答:
解:(1)TaS2(s)+2I2(g)?TaI4(g)+S2(g)△m
1 2 1 1 181+64=245
转化/mol
=0.02 0.04 0.02 0.02 4.9g
所以I2的平均反应速率=
=0.01mol/(L?min),
故答案为:0.01mol/(L?min);
(2)由所给方程式可知该反应为吸热反应,通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2,故答案为:<;
(3)a.根据反应速率之比等于系数之比,则v (I2)(正)=2v (S2)(正)=2v (S2)(逆),说明正反应速率与逆反应速率相等,故a正确;
b.平衡时I2与WI2浓度关系与转化率有关,二者浓度不一定相等,故b错误;
c.因为反应前后物质的量始终不变,不能说明反应达到平衡,故c错误;
d.随反应进行,混合气体的质量发生变化,恒容条件下密度也在不断变化,若容器内混合气体的密度保持不变,说明反应达到平衡,故d正确;
故答案为:ad;
(4)根据碳酸氢钠溶液显碱性,说明水解大于电离,又水解生成碳酸,电离生成碳酸根,所以CO32-与H2CO3浓度之比<1,故答案为:<;
(5)发生相互促进水解反应,生成氢氧化铝、二氧化碳、硫酸钠,该离子反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(6)加入盐酸生成二氧化碳,可知该药物为铝和镁的碱式碳酸盐,反应过程为:先发生H++OH-═H2O,再发生CO32-+H+═HCO3-,最后发生HCO3-+H+═CO2↑+H2O,
从42.5mL~45.0mL消耗2.5mL盐酸,其物质的量=0.0025L×2mol/L=0.005mol,则:
HCO3-+H+═CO2↑+H2O,
0.005mol 0.005mol
CO32-+H+═HCO3-
0.005mol 0.005mol 0.005mol
故与氢氧根反应的氢离子的物质的量=0.045L×2mol/L-0.005mol-0.005mol=0.08mol,则:
H++OH-═H2O
0.08mol 0.08mol
故该碱式盐样品中氢氧根与碳酸根的物质的量之比=0.08mol:0.005mol=16:1,
故答案为:16:1.
1 2 1 1 181+64=245
转化/mol
| 4.9 |
| 245 |
所以I2的平均反应速率=
| ||
| 2 |
故答案为:0.01mol/(L?min);
(2)由所给方程式可知该反应为吸热反应,通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2,故答案为:<;
(3)a.根据反应速率之比等于系数之比,则v (I2)(正)=2v (S2)(正)=2v (S2)(逆),说明正反应速率与逆反应速率相等,故a正确;
b.平衡时I2与WI2浓度关系与转化率有关,二者浓度不一定相等,故b错误;
c.因为反应前后物质的量始终不变,不能说明反应达到平衡,故c错误;
d.随反应进行,混合气体的质量发生变化,恒容条件下密度也在不断变化,若容器内混合气体的密度保持不变,说明反应达到平衡,故d正确;
故答案为:ad;
(4)根据碳酸氢钠溶液显碱性,说明水解大于电离,又水解生成碳酸,电离生成碳酸根,所以CO32-与H2CO3浓度之比<1,故答案为:<;
(5)发生相互促进水解反应,生成氢氧化铝、二氧化碳、硫酸钠,该离子反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(6)加入盐酸生成二氧化碳,可知该药物为铝和镁的碱式碳酸盐,反应过程为:先发生H++OH-═H2O,再发生CO32-+H+═HCO3-,最后发生HCO3-+H+═CO2↑+H2O,
从42.5mL~45.0mL消耗2.5mL盐酸,其物质的量=0.0025L×2mol/L=0.005mol,则:
HCO3-+H+═CO2↑+H2O,
0.005mol 0.005mol
CO32-+H+═HCO3-
0.005mol 0.005mol 0.005mol
故与氢氧根反应的氢离子的物质的量=0.045L×2mol/L-0.005mol-0.005mol=0.08mol,则:
H++OH-═H2O
0.08mol 0.08mol
故该碱式盐样品中氢氧根与碳酸根的物质的量之比=0.08mol:0.005mol=16:1,
故答案为:16:1.
点评:此题综合考查了反应速率的计算、化学平衡的移动、平衡状态的判断、化学方程式的书写及其基本计算等知识,难度较大.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
下列离子方程式书写错误的是( )
| A、在蓝色的淀粉溶液中通入足量SO2后成无色溶液:I2+SO2+2H2O=2I-+SO42-+4H+ |
| B、饱和Na2CO3溶液中通入CO2足量:2Na++CO32-+CO2+H2O=2NaHCO3↓ |
| C、钠投入CuSO4溶液中:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑ |
| D、向酸性KMnO4溶液中加入H2O2:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
某学生用标准的已知浓度的稀盐酸来滴定一未知浓度的NaOH溶液,下列操作可能会使溶液浓度的测定值偏低的是( )
| A、滴定管出口部分开始有气泡,滴定后气泡消失 |
| B、锥形瓶用蒸馏水冲洗后随即使用 |
| C、当看到锥形瓶中溶液的颜色发生变化后随即停止了滴定 |
| D、滴定管在用蒸馏水洗净后,即装入标准的酸溶液进行滴定 |
下列离子或分子在溶液中能大量共存,通入SO2后仍能大量共存的一组是( )
| A、Na+、Mg2+、Cl-、ClO- |
| B、NH3?H2O、SO32-、K+、Na+ |
| C、Fe2+、Na+、K+、NO3- |
| D、K+、Ca2+、Br-、Cl- |
化学电池可以直接将化学能转化为电能,化学电池的本质是( )
| A、化合价的升降 |
| B、电子的转移 |
| C、氧化还原反应 |
| D、电能的储存 |
 A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液先变红后褪色.据此回答下列问题:
A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液先变红后褪色.据此回答下列问题: