题目内容
已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ?mol-1.
①经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol?L-1、c(H2)=0.4mol?L-1、c(CH3OH)=0.8mol?L-1,则此时v正 v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
则0~15min,用H2表示的平均反应速率为 ,达到平衡时CO的转化率为 .
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
考点:化学平衡的计算,反应速率的定量表示方法
专题:化学平衡专题
分析:①依据计算浓度商和该温度下的平衡常数比较分析判断反应进行方向;
②温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,据此计算反应后气体体积的物质的量,从而计算氢气反应的物质的量,再根据v=
计算反应速率;根据CO反应的物质的量计算其转化率,化学反应速率概念计算v=
计算得到;转化率=
×100%.
②温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,据此计算反应后气体体积的物质的量,从而计算氢气反应的物质的量,再根据v=
| ||
| △t |
| △c |
| △t |
| 消耗量 |
| 起始量 |
解答:
解:①250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol?L-1、c(H2)=0.4mol?L-1、c(CH3OH)=0.8mol?L-1,浓度商Q=
=12.5>K=2.041,说明反应逆向进行v正<v逆;
故答案为:<;
②温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,15min,压强比(P后/P前)=0.80,则反应后气体的物质的量=3mol×0.80=2.40mol,气体减少的物质的量=3mol-2.4mol=0.6mol,根据气体减少的物质的量与氢气之间的关系式知,参加反应的氢气的物质的量=
×2=0.6mol,0~15min,用H2表示的平均反应速率=
=0.02 mol?( L?min)-1;
平衡状态压强比(P后/P前)=0.70,则反应后气体的物质的量=3mol×0.70=2.10mol,气体减少的物质的量=3mol-2.1mol=0.9mol,根据气体减少的物质的量与氢气之间的关系式知参加反应的CO的物质的量
=0.45mol,则CO的转化率=
×100%=45%,
故答案为:0.02 mol?( L?min)-1;45%.
| 0.8mol/L |
| 0.4mol/L×(0.4mol/L)2 |
故答案为:<;
②温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,15min,压强比(P后/P前)=0.80,则反应后气体的物质的量=3mol×0.80=2.40mol,气体减少的物质的量=3mol-2.4mol=0.6mol,根据气体减少的物质的量与氢气之间的关系式知,参加反应的氢气的物质的量=
| 0.6mol |
| 2 |
| ||
| 15min |
平衡状态压强比(P后/P前)=0.70,则反应后气体的物质的量=3mol×0.70=2.10mol,气体减少的物质的量=3mol-2.1mol=0.9mol,根据气体减少的物质的量与氢气之间的关系式知参加反应的CO的物质的量
| 0.9mol |
| 2 |
| 0.45mol |
| 1mol |
故答案为:0.02 mol?( L?min)-1;45%.
点评:本题考查了化学反应速率、平衡常数概念的理解应用,化学平衡的计算分析是关键,气体压强压强之比等于物质的量之比,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某同学设计如图所示装置,探究氯碱工业原理,下列说法正确的是( )
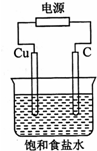

| A、石墨电极与直流电源负极相连 |
| B、用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色 |
| C、氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移 |
| D、铜电极的反应式为:2H++2e-═H2↑ |
中和滴定是一种操作简单,准确度高的定量分析方法.实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,下列有关几种具体的滴定分析(待测液置于锥形瓶内)的说法不正确的是( )
| A、用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度:滴定终点时,溶液由无色变为紫红色 |
| B、利用“Ag++SCN-═AgSCN↓”反应,用标准KSCN溶液测量AgNO3溶液浓度时可用Fe(NO3)3作指示剂 |
| C、利用“2Fe3++2I-═I2+2Fe2+”,用FeCl3溶液测量KI样品中KI的百分含量时可用淀粉作指示剂 |
| D、用标准NaOH溶液测量某盐酸溶液的浓度时,若用酚酞作指示剂,当观察到溶液由无色变红色,且半分钟不恢复时达到滴定终点 |
下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是( )
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液③Na2S2O3溶液与稀硫酸 ④Na2O2投入FeCl2溶液中⑤浓硫酸铵溶液加入到浓氢氧化钠中 ⑥Al2(SO4)3与Na2SiO3溶液.
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液③Na2S2O3溶液与稀硫酸 ④Na2O2投入FeCl2溶液中⑤浓硫酸铵溶液加入到浓氢氧化钠中 ⑥Al2(SO4)3与Na2SiO3溶液.
| A、①②④ | B、③④⑤ |
| C、①③④⑥ | D、①③④ |
下列实验中所选用的仪器或操作以及结论不合理的是( )
| A、容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 |
| B、在“催化剂对过氧化氢分解反应速率的影响”实验中,MnO2的用量以及颗粒直径的大小均会影响H2O2分解的速率,但溶液的酸碱性对H2O2的稳定性没有影响 |
| C、用锌和稀硫酸制H2时,向稀硫酸溶液中加入少量CuSO4溶液,可以加快制取H2的速率 |
| D、将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,与标准比色卡对照 |