题目内容
13.与水一样,甲醇也能微弱电离:2CH3OH(l)?CH3OH2++CH3O-,25℃时,K=2.0×10-17.若甲醇中加入少量金属钠,则下列叙述不正确的是( )| A. | 金属钠与水反应比金属钠与甲醇反应更剧烈 | |
| B. | 结合H+的能力CH3O-<OH- | |
| C. | 所得到溶液中K=c(CH3O-)×c(CH3OH2+) | |
| D. | 所得到溶液中c(Na+)+c(CH3OH2+)═c(CH3O-) |
分析 A.电离出来的氢离子浓度越大,与钠反应速率越大;
B.越难电离,则离子越易与氢离子结合;
C.K为甲醇中离子浓度的乘积;
D.根据电荷守恒分析.
解答 解:A.电离出来的氢离子浓度越大,与钠反应速率越大,水的电离程度大于甲醇,则水中氢离子浓度大,所以钠与水的反应比钠与甲醇反应更剧烈,故A正确;
B.越难电离,则离子越易与氢离子结合,甲醇难电离,则结合H+的能力CH3O->OH-,故B错误;
C.K为甲醇中离子浓度的乘积,则所得到溶液中K=c(CH3O-)×c(CH3OH2+),故C正确;
D.所得到溶液中存在电荷守恒,即c(Na+)+c(CH3OH2+)=c(CH3O-),故D正确.
故选B.
点评 本题考查了甲醇的电离、平衡常数、电荷守恒的应用等,题目难度不大,注意甲醇的电离程度比水小,侧重于考查学生的分析能力.

练习册系列答案
相关题目
19.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | 常温下,等物质的量浓度的三种溶液①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2)中c(NH4+):①<③<② |
4.工业制硝酸的主要反应为:4NH3(g)+5O2(g)?4NO(g)+6H2O(l)△H
(1)已知氢气的燃烧热为△H=-285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=-1168.8kJ/mol.
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
①反应在第2min到第4min时,O2的平均反应速率为0.1875mol/(L•min).
②反应在第6min时改变了条件,改变的条件可能是B(填序号).
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)?4NO(g)+6H2O(g)达到平衡状态的是ABE(填序号).
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
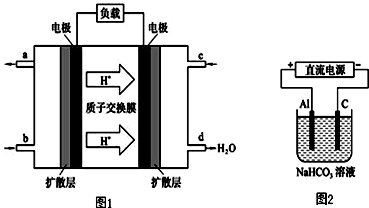
(3)某研究所组装的CH2=CH2-O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为C2H4.
②该电池负极的电极反应式为:C2H4-12e-+4H2O=2CO2+12H+.
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑(用相关的离子方程式表示).
(1)已知氢气的燃烧热为△H=-285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=-1168.8kJ/mol.
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
②反应在第6min时改变了条件,改变的条件可能是B(填序号).
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)?4NO(g)+6H2O(g)达到平衡状态的是ABE(填序号).
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH2=CH2-O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为C2H4.
②该电池负极的电极反应式为:C2H4-12e-+4H2O=2CO2+12H+.
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑(用相关的离子方程式表示).

5.在相同温度时,100mL 0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数据中,前者大于后者的是( )
①H+的物质的量 ②电离程度 ③中和时所需氢氧化钠溶液的量 ④醋酸的物质的量.
①H+的物质的量 ②电离程度 ③中和时所需氢氧化钠溶液的量 ④醋酸的物质的量.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
2.“三氯生”是一种高效广谱抗菌剂,广泛应用于牙膏、药皂、洗面奶、空气清新剂等.下面关于三氯生(C12H7Cl3O2)的说法中错误的是( )
| A. | 三氯生中含有氧气分子 | |
| B. | 三氯生由碳、氢、氯、氧四种元素组成 | |
| C. | 三氯生是一种有机物 | |
| D. | 一个三氯生分子共含有24个原子 |
 .
.