题目内容
在t℃时,将2mol SO2和2mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)
2SO3(g),请填写下列空白:
(1)下列叙述能证明该反应已达到化学平衡状态的是(填标号) .
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n mol SO2的同时生成n mol O2
F.容器内混合气体的密度不再改变
G.容器内气体的平均摩尔质量不再改变
(2)反应2min后,测得O2的浓度为0.8mol/L,则这2min内生成SO3的平均反应速率为 ;此时SO2的转化率为 .
(3)反应达到平衡时,测得容器内的压强减小了20%,则平衡时氧气的转化率为 .
| 催化剂 |
| △ |
(1)下列叙述能证明该反应已达到化学平衡状态的是(填标号)
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n mol SO2的同时生成n mol O2
F.容器内混合气体的密度不再改变
G.容器内气体的平均摩尔质量不再改变
(2)反应2min后,测得O2的浓度为0.8mol/L,则这2min内生成SO3的平均反应速率为
(3)反应达到平衡时,测得容器内的压强减小了20%,则平衡时氧气的转化率为
考点:化学平衡状态的判断,化学平衡的计算
专题:化学平衡专题
分析:(1)化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断;
(2)速率之比等于对应物质的化学计量数之比,可以根据已知条件求出氧气的反应速率,然后运用关系式,SO2的转化率为
×100%;
(3)容器内的压强减小了20%,压强之比等于物质的量之比.
(2)速率之比等于对应物质的化学计量数之比,可以根据已知条件求出氧气的反应速率,然后运用关系式,SO2的转化率为
| 变化量 |
| 起始量 |
(3)容器内的压强减小了20%,压强之比等于物质的量之比.
解答:
解:(1)A.容器内压强不再发生变化,说明物质的量不变,正反应速率等于逆反应速率,故选;
B.SO2的体积分数不再发生变化,说明物质的量不变,正反应速率等于逆反应速率,故选;
C.容器内气体原子总数不再发生变化,一直未变,故不选;
D.相同时间内消耗2n mol SO2的同时消耗n mol O2,一直相等,故不选;
E.相同时间内消耗2n mol SO2等效于消耗n mol O2,同时生成n mol O2,正反应速率等于逆反应速率,故选;
F.容器内混合气体的密度不再改变,一直未变,故不选;
G.容器内气体的平均摩尔质量不再改变,说明物质的量不变,正反应速率等于逆反应速率,故选;
故选:ABEG;
(2)反应2min后,测得O2的浓度为0.8mol/L,则v(O2)=
=0.1mol/(L?min),所以v(SO3)=2v(O2)=2×0.1mol/(L?min)=0.2mol/(L?min),SO2的转化率为
×100%=40%,故答案为:0.2mol/(L?min);40%;
(3)氧气的转化率为x,则由方程式 2SO2(g)+O2(g)?2SO3(g),
初起量:2mol 2mol 0
变化量:4x 2x 4x
平衡量:2-4x 2-2x 4x
由题意可知:
×100%=1-20%,解得x=0.4mol
则平衡时氧气的转化率为
×100%=40%,故答案为:40%.
B.SO2的体积分数不再发生变化,说明物质的量不变,正反应速率等于逆反应速率,故选;
C.容器内气体原子总数不再发生变化,一直未变,故不选;
D.相同时间内消耗2n mol SO2的同时消耗n mol O2,一直相等,故不选;
E.相同时间内消耗2n mol SO2等效于消耗n mol O2,同时生成n mol O2,正反应速率等于逆反应速率,故选;
F.容器内混合气体的密度不再改变,一直未变,故不选;
G.容器内气体的平均摩尔质量不再改变,说明物质的量不变,正反应速率等于逆反应速率,故选;
故选:ABEG;
(2)反应2min后,测得O2的浓度为0.8mol/L,则v(O2)=
| (1-0.8)mol/L |
| 2min |
| 0.2mol/L×2L×2 |
| 2mol |
(3)氧气的转化率为x,则由方程式 2SO2(g)+O2(g)?2SO3(g),
初起量:2mol 2mol 0
变化量:4x 2x 4x
平衡量:2-4x 2-2x 4x
由题意可知:
| 2-4x+2-2x+ 4x |
| 2+2 |
则平衡时氧气的转化率为
| 0.4mol×2 |
| 2mol |
点评:本题考查化学平衡的判断和计算,题目有一定难度,本题易错点为(3).

练习册系列答案
相关题目
下列各组离子在指定环境中一定能大量共存的是( )
| A、滴加甲基橙试液显红色的溶液:Fe2+、NH4+、SCN-、ClO- |
| B、含有大量SO42-的溶液:NH4+、Mg2+、Cl-、NO3- |
| C、水电离出的c(H+)=1×10-12 mol/L的溶液:S2O32-、C2O42-、K+、Na+ |
| D、能与Al反应放出H2的溶液:K+、Na+、NO3-、SO42- |
 在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为1L),则下列判断正确的是( )
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为1L),则下列判断正确的是( )| A、图中线段oa:ab=3:1 |
| B、NaOH溶液物质的量浓度为0.6 mol?L-1 |
| C、在b点处溶液中的溶质只有Na[Al(OH)4] |
| D、混合溶液中Al3+与Mg2+物质的量比值为2:1 |






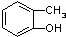 和
和 ⑥
⑥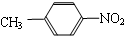 和
和