题目内容
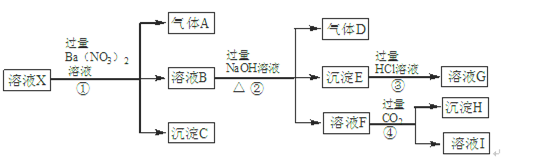
有十种物质:①铁丝;②CO气体;③CO2气体;④硫酸;⑤CaO固体;⑥盐酸;⑦(NH4) 2SO4晶体;⑧熔融NaOH;⑨液态氯化氢;⑩酒精,以上物质中:
(1)属于非电解质的有 (填代号),属于酸性氧化物的有 (填代号),题中所示状态能导电且属于电解质的有 (填代号)。
(2)属于盐的物质其电离方程式为: 。
(1)②③⑩ ③ ⑧ (2)(NH4) 2SO4=2NH4+ + SO42-
解析试题分析:非电解质为非金属氧化物和一些有机物,CO2为酸性氧化物,可与碱反应生成盐和水。熔融状态能导电的为强碱,大多数盐和多数金属氧化物。(NH4) 2SO4为强电解质,发生完全电离。
考点:电解质和非电解质的定义。

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
1 L 某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、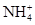 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、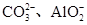 |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是________________。

(2)BC段的离子方程式为__________________________。
(3)V1、V2与V3、V4之间的关系为____________________。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2L |
| n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
| n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为____________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_________________。
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH 、Fe3+ 、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO 、AlO 、AlO |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧 化钠溶液的体积(V)的关系如图所示。

①该溶液中一定含有的阳离子是______________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示, 分析后回答下列问题:
| Cl2的体积(标准状况) | 5.6 L | 11.2 L | 22.4 L |
| n (Cl-) | 2.5 mol | 3.0 mol | 4.0 mol |
| n (Br-) | 3.0 mol | 2.8 mol | 1.8 mol |
| n (I-) | x mol | 0 | 0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。