题目内容
4.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | R的气态氢化物的水溶液显酸性 |
分析 这几种元素都是短周期元素,根据元素在周期表中的位置知,R位于第二周期,T、Q和W位于第三周期,T所处的周期序数与族序数相等,则T为Al元素,Q、R、W分别是Si、N、S元素,
A.元素的非金属性越强,其简单氢化物的热稳定性越强;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
D.R是N元素,其氢化物是氨气,氨气水溶液呈碱性.
解答 解:这几种元素都是短周期元素,根据元素在周期表中的位置知,R位于第二周期,T、Q和W位于第三周期,T所处的周期序数与族序数相等,则T为Al元素,Q、R、W分别是Si、N、S元素,
A.元素的非金属性越强,其简单氢化物的热稳定性越强,非金属性R>Q,所以最简单气态氢化物的热稳定性:R>Q,故A正确;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性W>Q,所以最高价氧化物对应水化物的酸性:Q<W,故B正确;
C.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,原子半径:T>Q>R,故C正确;
D.R是N元素,其氢化物是氨气,氨气水溶液呈碱性,故D错误;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断及对元素周期律应用能力,知道非金属性与氢化物稳定性、其最高价氧化物的水化物酸性关系,易错选项是D.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
15.下列除杂的方法错误的是( )
| 物质 | 杂质 | 除杂试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | Mg | Al | NaOH溶液 | 过滤 |
| C | FeCl2 | FeCl3 | Cu | 过滤 |
| D | NaCl | 泥沙 | 加水 | 溶解、过滤、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
19.下列有机物的命名正确的是( )
| A. | 1,2─二甲基戊烷 | B. | 2─乙基戊烷 | C. | 2,3─二甲基戊烷 | D. | 3─甲基己烷 |
9.用下列实验装置进行相应实验,能达到实验目的是( )
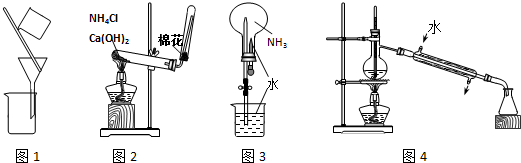

| A. | 用图1装置分离乙醇和乙酸 | B. | 用图2装置制取氨气 | ||
| C. | 用图3装置进行氨气的喷泉实验 | D. | 用图4装置进行石油的分馏实验 |
16.下列说法中,正确的是( )
| A. | 苯和甲苯都能与卤素单质、硝酸等发生取代反应 | |
| B. | 苯的同系物是分子中仅含有一个苯环的所有烃类物质 | |
| C. | 烯烃在适宜的条件下只能发生加成反应不能发生取代反应 | |
| D. | 分子式是C4H8的烃分子中一定含有碳碳双键 |
13.标况下,某混合气体由两种气态烃组成,2.24L该混合气体完全燃烧后,得到4.48L二氧化碳和3.6克水,则这两种气体可能是( )
| A. | CH4和 C3H8 | B. | CH4和C3H4 | C. | C2H2和C3H4 | D. | C2H4和C2H6 |
14.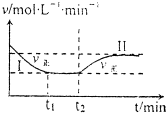 在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )
在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )
 在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )
在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)?2NH3(g)△H<O.t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ | |
| C. | Ⅰ、Ⅱ两过程达到平衡的标志:气体密度不再发生变化 | |
| D. | t2时刻改变的条件可以是向密闭容器中加H2和N2混合气 |
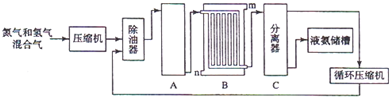
 H2+CO,CH4+H2O
H2+CO,CH4+H2O 3H2+CO;
3H2+CO;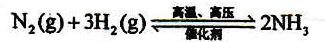 ;
;