题目内容
20.下列离子方程式正确的是( )| A. | 稀盐酸加入大理石中:CO32-+2H+═H2O+CO2↑ | |
| B. | 氢氧化钡溶液中加入稀硫酸SO42-+Ba2+═BaSO4↓ | |
| C. | 硫酸溶液加入Cu(OH)2中:2H++Cu(OH)2═Cu2++2H2O | |
| D. | 稀盐酸加入铁粉中:2Fe+6H+═2Fe3++3H2↑ |
分析 A.碳酸钙为沉淀,应保留化学式;
B.漏掉氢氧根离子与氢离子的反应;
C.二者反应生成硫酸铜和水;
D.不符合反应客观事实.
解答 解:A.稀盐酸加入大理石中,离子方程式:CaCO3+2H+═H2O+CO2↑+Ca2+,故A错误;
B.氢氧化钡溶液中加入稀硫酸,离子方程式:2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O,故B错误;
C.硫酸溶液加入Cu(OH)2中,离子方程式:2H++Cu(OH)2═Cu2++2H2O,故C正确;
D.稀盐酸加入铁粉中反应生成氯化亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、注意化学式的拆分,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.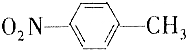 和
和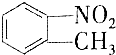 的一些物理性质如下表所示:
的一些物理性质如下表所示:
(1)分离这两种物质的混合物可采用的方法是D(填字母).
A.过滤 B.分液 C.蒸发 D.分馏
(2)实验需要用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、温度计、冷凝管以及锥形瓶.
 和
和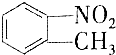 的一些物理性质如下表所示:
的一些物理性质如下表所示:| 物质 | 熔点 | 沸点 | 密度 | 水溶性 |
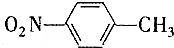 | -10℃ | 212℃ | 1.1622g/cm3 | 不溶于水 |
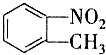 | 54℃ | 238℃ | 1.1581g/cm3 | 不溶于水 |
A.过滤 B.分液 C.蒸发 D.分馏
(2)实验需要用到的主要玻璃仪器是蒸馏烧瓶、酒精灯、温度计、冷凝管以及锥形瓶.
11.下表是周期表中的一部分,根据A~I在周期表中的位置,用相对应的元素符号或化学式 回答下列问题.
表中元素,原子半径最小的是H,原子半径最大的是Na化学性质最不活泼的是Ne,氧化性最强的单质是F2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | H | |||||||
| 二 | C | N | F | Ne | ||||
| 三 | Na | Al | P | S |
8.下列说法中不正确的是( )
| A. | 电子数相同的粒子不一定属于同种元素 | |
| B. | 两个原子如果核外电子排布相同,一定属于同种元素 | |
| C. | 质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子 | |
| D. | 所含质子数和电子数相等的粒子一定是原子 |
15.对物质进行科学分类,有利于把物质本质属性和物质间内在联系,以下关于物质的分类正确的是( )
| 氧化物 | 酸 | 碱 | 盐 | |
| A | Fe3O4 | CH3COOH | NH3•H2O | (NH4)2SO 4 |
| B | SO2 | H2SO4 | NaOH | Na2O2 |
| C | CO | HNO3 | Cu2(OH)2CO3 | FeSO4 |
| D | H2O | NaHSO4 | Ba(OH)2 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
5.某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-.酸性或碱性条件下,溶液中能大量存在的离子最多有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
12.两种气态烃以任意比例混合,在105℃时lL该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,下列各组混合烃中符合此条件的是( )
| A. | CH4 C2H6 | B. | C2H4 C3H6 | C. | C2H4 C3H4 | D. | C2H6 C3H6 |
9.有机物A与氢气的相对密度是38,称取有机物A 7.6g完全燃烧后,生成8.8g CO2和3.6gH2O.此有机物能与碳酸氢钠反应,但不能发生水解.下列有关A的说法中不正确的是( )
| A. | A的分子式为C2H4O3 | |
| B. | A的结构简式为HOCH2COOH | |
| C. | A分子中的官能团有两种 | |
| D. | 1 mol A与足量的单质Na反应时放出H2的物质的量为0.5mol |
10.用含Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.工艺流程如下: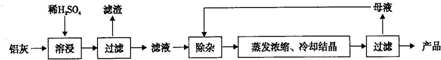
(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验滤液中还存在Fe2+的方法是取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
Ⅰ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3.2;
Ⅱ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅲ.加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的是将Fe2+氧化为Fe3+;调节溶液的pH为3.2的目的是调节pH值使铁元素沉淀完全.
②向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是有黄绿色气体生成.
③Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式).

(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(2)检验滤液中还存在Fe2+的方法是取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
Ⅰ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3.2;
Ⅱ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅲ.加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的是将Fe2+氧化为Fe3+;调节溶液的pH为3.2的目的是调节pH值使铁元素沉淀完全.
②向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是有黄绿色气体生成.
③Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式).